16.15:
酸-碱 滴定曲线
É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
JoVE Core
Química
Acid-Base Titration Curves
111,889 Views
•
02:23 min
•
September 24, 2020
滴定曲线是一些溶液属性与添加滴定剂的数量的图解。 对于 酸-碱 滴定,溶液 pH 是一种有用的属性进行监测,因为它可以预测地随溶液成分的变化而变化,因此可以用于监测滴定的进展并检测其终点。 酸-碱 滴定可通过强酸和强碱,强酸和弱碱,强碱和弱酸来执行。
对于使用强碱 NaOH 的 0.100 M 强酸对 25.00 mL 0.100 M HCL 进行滴定,其滴定曲线在图 1a 中显示为红色。 对于使用 0.100 M NaOH 的 25.00 mL 0.100 M CH3COOH (弱酸) 滴定,其滴定曲线在图 1b 中显示为黄色。
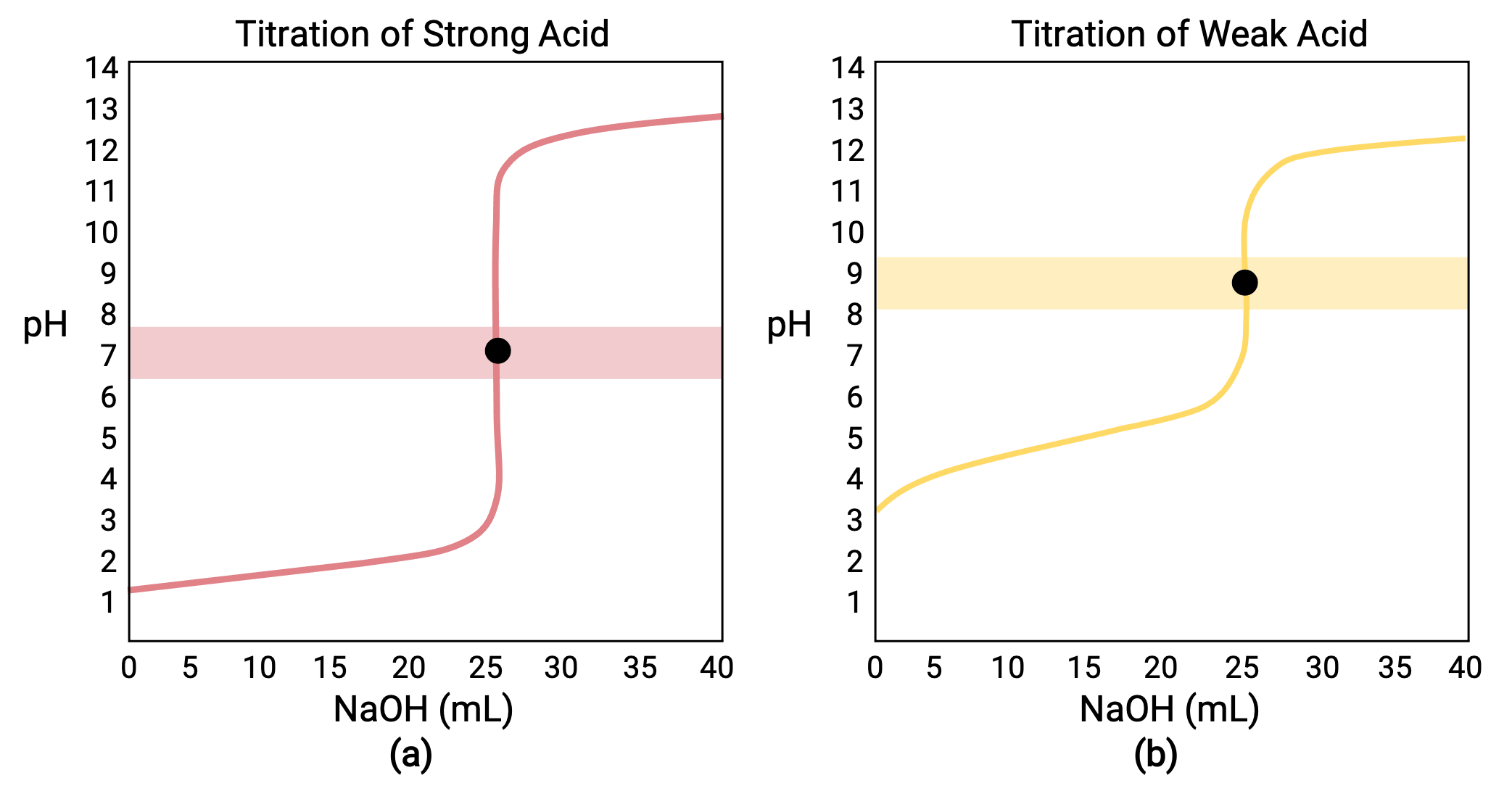
图 1 (a) 含 0.100 M NaOH (强碱) 的 25 mL 0.100 M HCL (强酸) 滴定曲线的等效点为 7.00 pH。 (b) 25 mL 0.100 M 乙酸 (弱酸) 与 100 M NaOH (强碱) 滴定曲线的等效点为 8.72 pH。
使用强酸的强或弱碱的滴定具有类似的 S 形曲线;但是,曲线会反转,因为 pH 值将从基本区域开始,随着强酸的增加而降低。 弱酸或碱的滴定也可用于分别确定 Ka 或 Kb。
滴定的四个阶段:
- 初始状态 (添加滴定剂体积 = 0 mL) : pH 由滴定酸确定;由于两个酸样本均浓度相同,弱酸的初始 pH 值将更高
- 前等效点 (0 mL < V < 25 mL) :溶液 pH 逐渐升高,酸通过反应被添加滴定剂消耗;成分包括未反应酸和反应生成物及其共轭碱
- 等效点 (V = 25 mL) :当溶液成分从酸性过渡到中性 (对于强酸样本) 或碱性 (对于弱酸样本) 时, pH 值会急剧上升, pH 值由酸的共轭碱电离决定
- 后等效点 (V > 25 mL) : pH 由添加了过量强碱滴定剂的数量确定;由于两个样本都使用相同滴定剂滴定,因此这一阶段的两个滴定曲线都类似。
