9.5:
Dégradation radioactive et datation radiométrique
22,553 Views
•
•
La radioactivité est une désintégration spontanée d’un nucléide instable et c’est un processus aléatoire, car tous les noyaux de l’échantillon ne se désintègrent pas simultanément. Le nombre de désintégrations par unité de temps est appelé l’activité (A), qui est directement proportionnelle au nombre de noyaux dans l’échantillon. La constante de décroissance (λ) est une probabilité moyenne de décroissance par noyau en unité de temps.
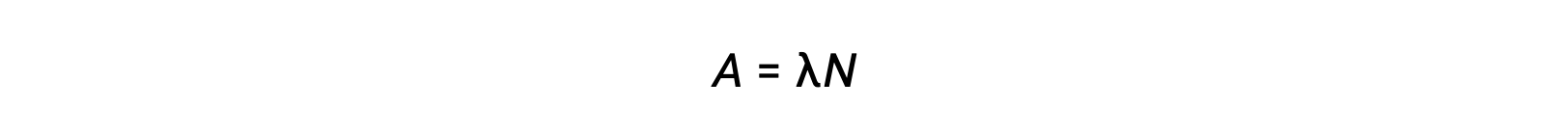
L’unité SI pour l’activité est le becquerel, qui est une désintégration par seconde. Une autre unité de l’activité est le curie, qui est égal à 37 milliards de becquerels. Le tracé de l’activité par rapport au temps pour différents radionucléides indique des taux de décroissance différents. Le temps nécessaire pour que l’activité chute de n’importe quelle valeur à la moitié de cette valeur correspond à une demi-vie, indiquée par t1/2.
Comme l’activité est proportionnelle au nombre d’atomes radioactifs, elle diminue avec le temps à mesure que la quantité d’échantillon diminue. Mathématiquement, l’activité d’un radionucléide est indiquée par une équation exponentielle :
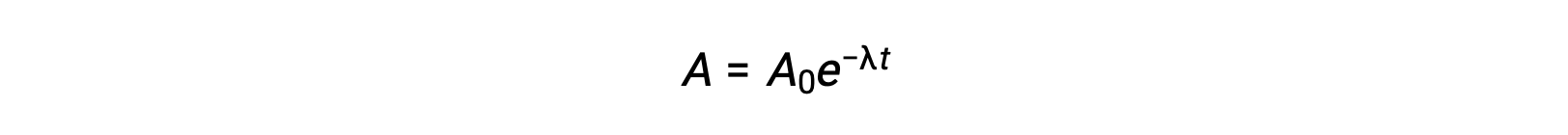
Ainsi, lorsque l’activité est réduite de moitié, la réorganisation de l’équation permet de calculer la demi-vie, qui est inversement proportionnelle à la constante de décroissance.
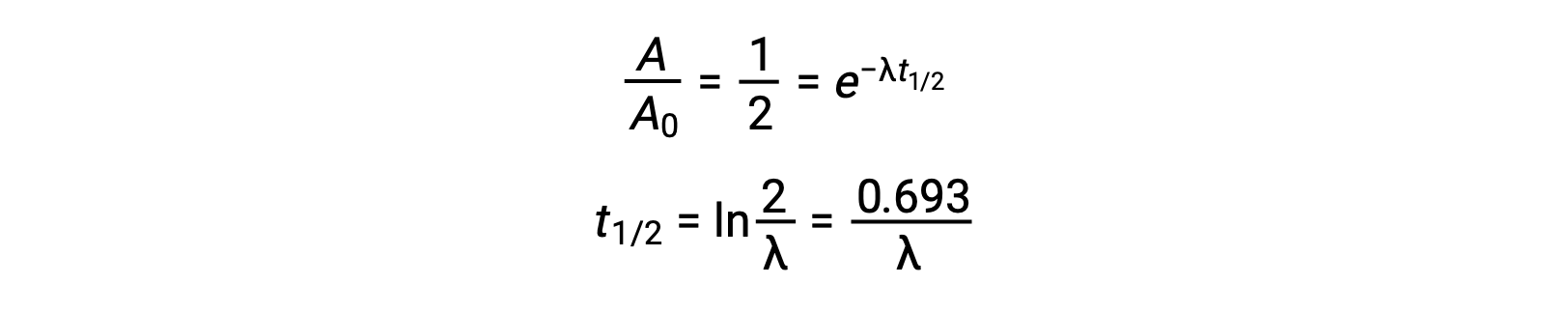
Une demi-vie est une propriété intrinsèque d’un radionucléide, et tout atome unique d’un nucléide instable a la même demi-vie, qu’il soit complètement seul dans le vide ou dans un échantillon avec beaucoup d’autres atomes de ce nucléide. Les demi-vies des radionucléides varient grandement ; le radon 220 a une demi-vie de 1 minute : un million de noyaux décroît à un demi-million en une minute et décroît encore jusqu’à un quart de million en une autre minute. Cependant, le thorium 232 a une demi-vie de 14 milliards d’années.
Plusieurs radio-isotopes ont des demi-vies et d’autres propriétés qui les rendent utiles à des fins de “ datation ” de l’origine temporelle d’objets tels que des artefacts archéologiques, des organismes autrefois vivants ou des formations géologiques.
Le carbone 14, un radionucléide d’une demi-vie de 5730 ans, fournit une méthode pour dater des objets qui faisaient partie d’un organisme vivant. Cette méthode de datation radiométrique est exacte pour la datation des substances contenant du carbone qui ont jusqu’à environ 30000 ans et elle peut fournir des dates raisonnablement exactes allant jusqu’à un maximum d’environ 50000 ans.
Le carbone qui se trouve dans la nature se compose de trois isotopes : le carbone 12, qui représente environ 99 % du carbone sur terre ; le carbone 13, environ 1 % du total ; et des traces de carbone 14. Le carbone 14 se forme dans la haute atmosphère par la réaction des atomes d’azote avec les neutrons des rayons cosmiques dans l’espace.
Tous les isotopes du carbone réagissent avec l’oxygène pour produire des molécules de CO2. Ainsi, les plantes et les animaux vivants ont un rapport de carbone 14 et carbone 12 identique à l’atmosphère. Mais lorsque la plante ou l’animal meurt, le réapprovisionnement du carbone s’arrête, et le rapport carbone 14 à 12 commence à diminuer puisque le carbone 14 radioactif décroît continuellement. Par exemple, si le rapport carbone 14/carbone 12 dans un objet en bois trouvé lors d’une fouille archéologique est la moitié de ce qu’il est dans un arbre vivant, cela suggère que l’objet a été fabriqué à partir de bois coupé il y a 5730 ans. À l’aide d’un spectromètre de masse, des déterminations d’une grande exactitude des rapports entre le carbone 14 et le carbone 12 peuvent être obtenues à partir de très petits échantillons (aussi peu qu’un milligramme).
La datation radioactive peut également utiliser d’autres nucléides radioactifs avec des demi-vies plus longues pour dater des événements plus anciens. Par exemple, l’uranium 238, qui se désintègre suivant une série d’étapes en plomb 206, peut être utilisé pour établir l’âge des roches (et l’âge approximatif des roches les plus anciennes sur terre). Puisque l’uranium 238 a une demi-vie de 4,5 milliards d’années, il faut ce temps pour que la moitié de l’uranium 238 originel se transforme en plomb 206. Dans un échantillon de roche qui ne contient pas de quantités notables de plomb 208, l’isotope le plus abondant du plomb, nous pouvons supposer que le plomb n’était pas présent lorsque la roche a été formée. Par conséquent, en mesurant et en analysant le rapport U-238/Pb-206, nous pouvons déterminer l’âge de la roche. Cela suppose que tout le plomb 206 présent provient de la désintégration de l’uranium 238. S’il y a du plomb 206 supplémentaire, ce qui est indiqué par la présence d’autres isotopes du plomb dans l’échantillon, il est nécessaire d’effectuer un ajustement. La datation potassium–argon utilise une méthode similaire. Le potassium 40 se désintègre par l’émission de positrons et la capture d’électrons pour former l’argon 40 avec une demi-vie de 1,25 milliards d’années. Si un échantillon de roche est broyé et que la quantité d’argon 40 gazeux qui s’échappe est mesurée, la détermination du rapport Ar-40/K-40 donne l’âge de la roche.
Ce texte est adapté de Openstax, Chimie 2e, Section 21.3 : Désintégration radioactive.
