18.2:
Força Eletromotriz
21,775 Views
•
•
A eletricidade é gerada por eletrões ou iões que fluem através de uma solução ou um meio condutor. Este fluxo de eletrões ou carga elétrica específica é definido como uma corrente elétrica. Quando os eletrões se deslocam através de um fio, geram uma corrente elétrica. Pode-se lembrar que em uma reação redox, eletrões são perdidos e adquiridos. Na reação redox espontânea do zinco com cobre, quando o zinco é imerso em uma solução de iões de cobre, ocorre uma transferência de eletrões de uma substância para outra.
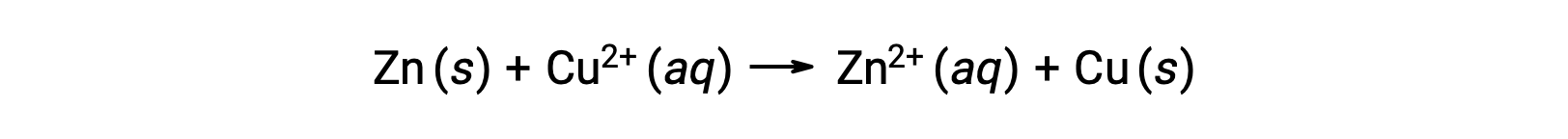
O zinco, com maior tendência para perder eletrões, é oxidado em iões de zinco, enquanto que os iões de cobre são reduzidos para cobre sólido. No entanto, esta reação não gera eletricidade.
Corrente Elétrica e Como Fluem os Eletrões
A transferência de eletrões ocorre diretamente de um agente redutor para um agente oxidante em uma solução. Mesmo que os componentes das semi-reações estejam fisicamente isolados em recipientes separados e conectados por um condutor externo, como um fio, a tendência de perder e ganhar eletrões pelos reagentes ainda persiste. No entanto, os eletrões são assim forçados a fluir através do fio que liga as duas semi-reações. Este fluxo de eletrões através do fio constitui uma corrente elétrica e pode alimentar aparelhos eletrónicos, como uma lâmpada. A corrente elétrica é medida em amperes. Um ampere é igual ao fluxo de um coulomb de carga elétrica por segundo e é igual a 6,24 × 10−18 eletrões por segundo.
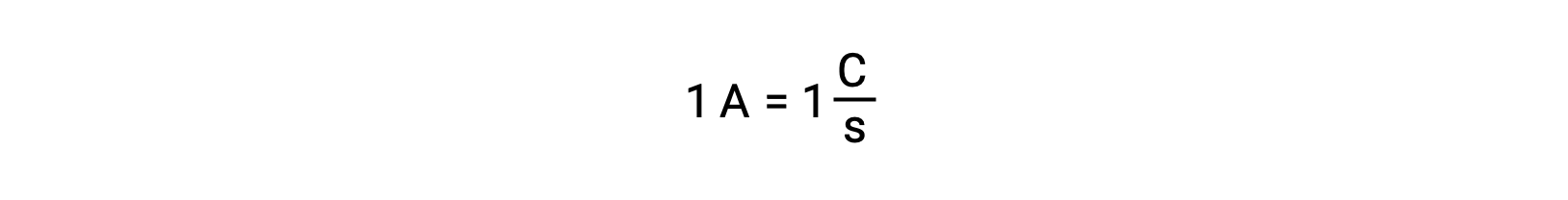
Uma vez que um eletrão tem uma carga de 1,602 × 10−19 C, 1 ampere correlaciona-se com o fluxo de 6,242 × 1018 eletrões por segundo.
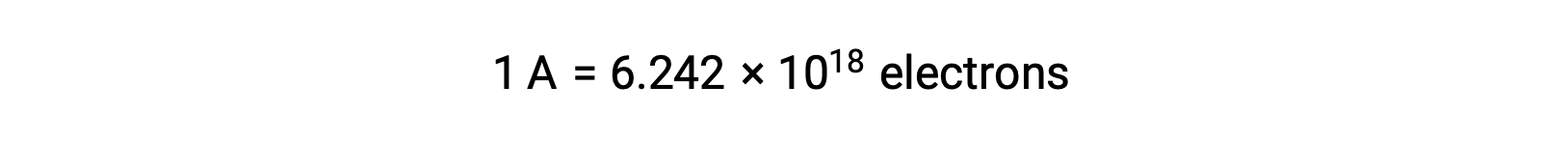
Força Motriz para Corrente Elétrica, Diferença de Potencial, e Emf
O fluxo de corrente elétrica é semelhante ao fluxo de água através de uma cascata. A água é impulsionada pela diferença na energia potencial gravitacional, enquanto que o fluxo de eletrões é impulsionado pela diferença da energia potencial elétrica entre os reagentes. Essa diferença na energia de potencial elétrico é descrita pelos termos diferença de potencial, força eletromotriz (emf), ou potencial da célula. A emf é uma medida da força motriz entre dois reagentes e a tendência para transferência de eletrões.
Algumas reações redox são espontâneas, enquanto que outras não são. Por exemplo, um fio de cobre sofre oxidação espontânea por iões de prata(I), mas não produz qualquer reação quando imerso em uma solução de iões de chumbo(II). Isto deve-se à diferença na atividade redox das duas espécies, Ag+ (aq) e Pb2+ (aq), em relação ao cobre: o ião de prata oxida espontaneamente o cobre, mas o ião de chumbo não. Esta diferença na reatividade redox em eletroquímica pode ser quantificada utilizando o termo ‘potencial de célula’; também conhecido como ‘voltagem’.
O potencial da célula de dois reagentes isolados é medido com um voltímetro, que é lido em voltagem da célula. Um volt correlaciona-se a um joule de energia potencial por um coulomb de carga elétrica.
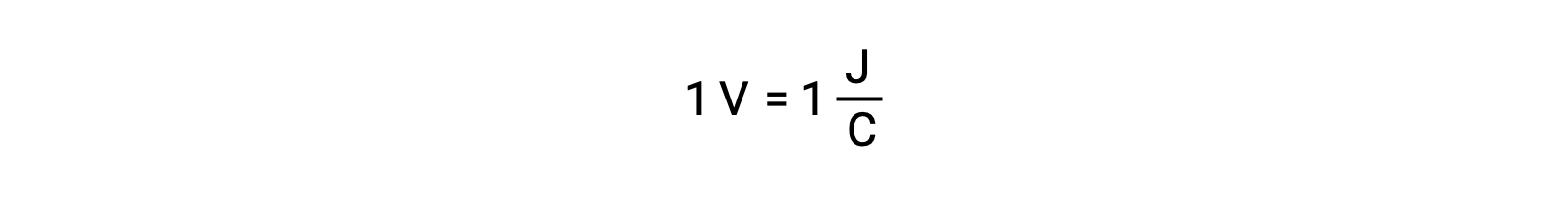
Um potencial de célula alto indica uma grande força motriz e maior facilidade de transferência de eletrões. Por fim, a força eletromotriz, ou potencial de célula, depende da natureza dos reagentes, da temperatura da reação, e da concentração de iões presentes na reação.
Este texto é adaptado de OpenStax, Chemistry 2e, Section 17.3: Electrode and Cell Potentials.
