18.2:
电动势
21,775 Views
•
•
电是由流经溶液或导电介质的电子或离子产生的。 这种电子流或特定的电荷被定义为电流。 当电子通过电线移动时,它们会产生电流。 可以回顾 ,在氧化还原反应中,电子会丢失和获得。 在锌 与铜的自发氧化还原反应中,当锌浸入铜离子溶液中时,电子从一种物质转移到另一种物质。
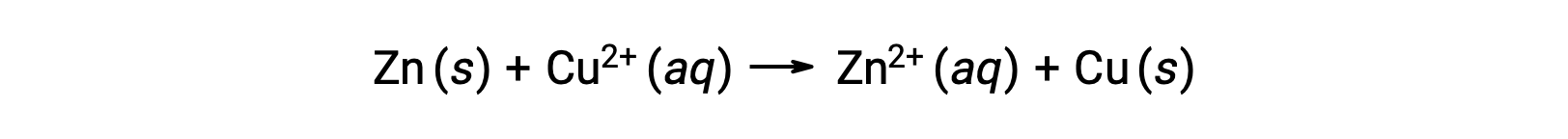
锌具有更大的失去电子的倾向,被氧化成锌离子,而铜离子则被还原为固体铜。 但是,这种反应不会产生电。
电流和电子的流动方式
电子转移直接从溶液中的还原剂转移到氧化剂。 即使半反应的组成部分在单独的容器中被物理隔离并通过外部导体 (如电线) 连接,反应物丢失和获取电子的趋势仍然存在。 但是,现在,电子被迫流过连接两个半反应的导线。 这种通过电线的电子流构成了电流,可以为电子设备 (如灯泡) 供电。 电流以安培为单位测量。 一安培等于每 秒一个库伦电荷的流量,等于每秒 6.24 × 10−18 个电子。
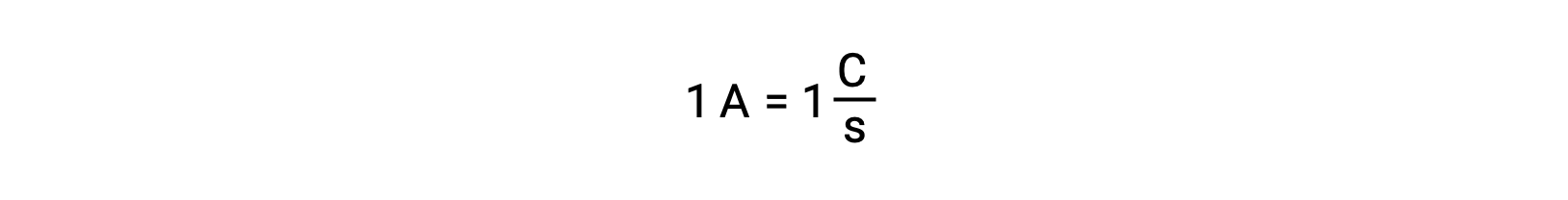
由于电子的电荷为 1.602 × 10−19 C , 1 安培与每秒 6.242 × 1018 个电子的流量相关。
用于电流,电势差和电动势的驱动力
电流的流动类似于流过瀑布的水。 引力势能的差异驱动着水,而电子的流动则由反应物之间的电气势能的差异驱动。 “电势差” (Potential Difference) ,“电动势 (EMF) ” (电势差) 或“电池电势” (电势差) 一词描述了电气势能的这一差异。 EMF 是两个反应物和电子传输趋势之间的驱动力的度量单位。
有些氧化还原反应是自发的,而另一些反应则不是自发的。 例如,铜线会被银㈠离子自发氧化,但浸入铅㈡离子的溶液时,未能产率任何反应。 这是由于 AA+ (AQ) 和 Pb2+ (AQ) 这两个物种对铜的氧化还原活动不同:银离子会自动氧化铜,但铅离子不会氧化。 电化学中氧化还原反应的这一差异可以使用 ‘电池电势’ (电压) 一词来量化,通常也称为 ‘Voltage ’ (电压)。
两个隔离反应物的电池电势由一个电压表测量,电压表以单元电压为单位。 一伏电压与每一个库伦的电荷一焦耳势能相关。
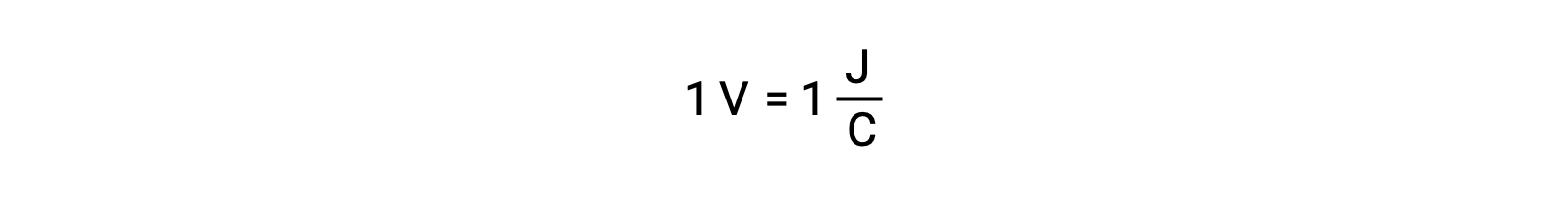
高电池电势表示驱动力大且电子传输更容易。 最后,电动势或电池电势取决于反应物的性质,反应温度和反应中存在的离子的浓度。
