17.9:
Изменения свободной энергии для нестандартных состояний
9,427 Views
•
•
изменение свободной энергии для процесса, проходящего с реагентами и продуктами, находящимися в нестандартных условиях (давления, отличные от 1 бар; концентрации, отличные от 1 М), относится к стандартному изменение свободной энергии в соответствии с этим уравнением:
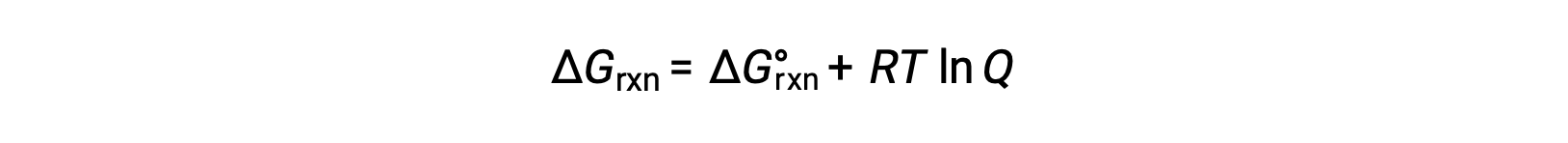
Где R — постоянная газа (8.314 Дж/K·моль), T — абсолютная температура в кельвине, а Q — коэффициент реакции. Это уравнение можно использовать для прогнозирования спонтанности процесса при любом заданном наборе условий.
Коэффициент реакции (Q)
Состояние реакции обратимая удобно оценивается путем оценки ее коэффициента реакции Q. для реакции обратимая, описанной в.
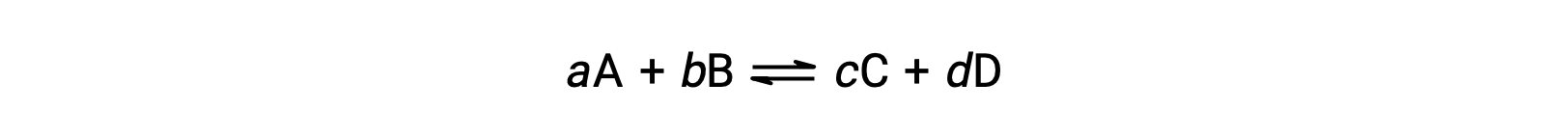
коэффициент реакции определяется непосредственно на основе стехиометрии сбалансированного уравнения as
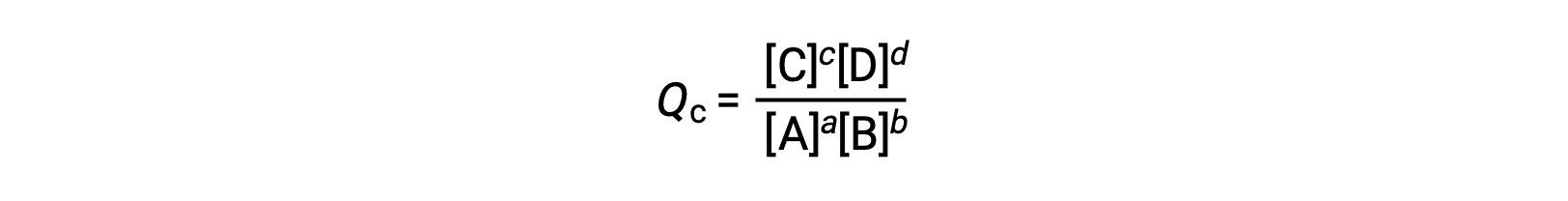
где индекс c обозначает использование молярных концентраций в выражении. Коэффициент реакции на основе концентрации, КК, используется для сгущенного фазового равновесия. Если реагенты и продукты газообразны, коэффициент реакции может быть аналогичным образом получен с использованием парциального давления:
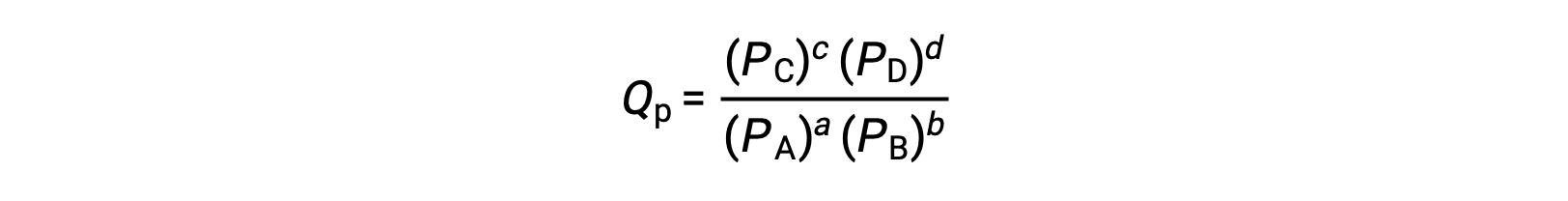
В стандартных условиях концентрация реагент и раствор продукта составляет 1 м, или давление газов составляет 1 бар, а Q равно 1. Поэтому в стандартных условиях
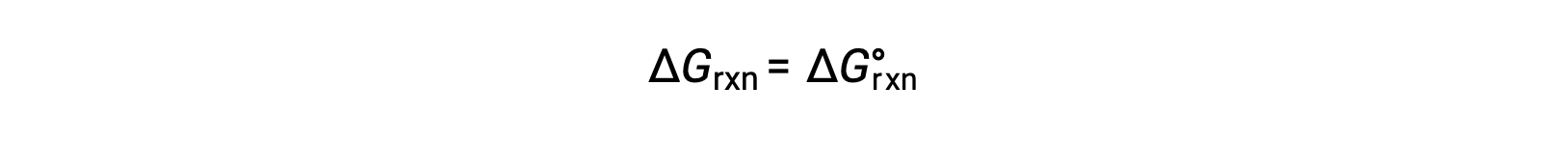
При нестандартных условиях необходимо рассчитать Q.
Численное значение Q изменяется по мере того, как реакция идет к равновесию; поэтому оно может служить полезным индикатором состояния реакции. Чтобы проиллюстрировать этот момент, рассмотрите окисление диоксида серы:
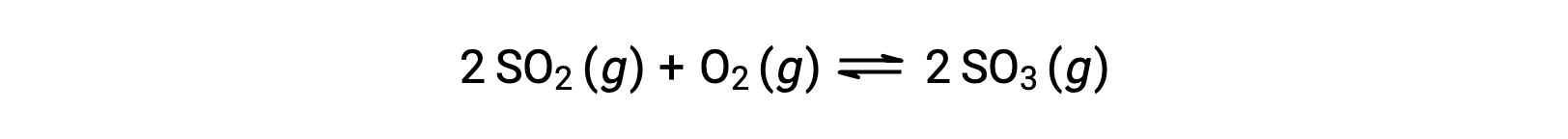
Рассмотрим два различных экспериментальных сценария, один из которых инициируется с использованием смеси только реагенты, SO2 и O2, а другой, который начинается только с продукта SO3. Для реакции, начинающейся только с смеси реагенты, Q изначально равен нулю:
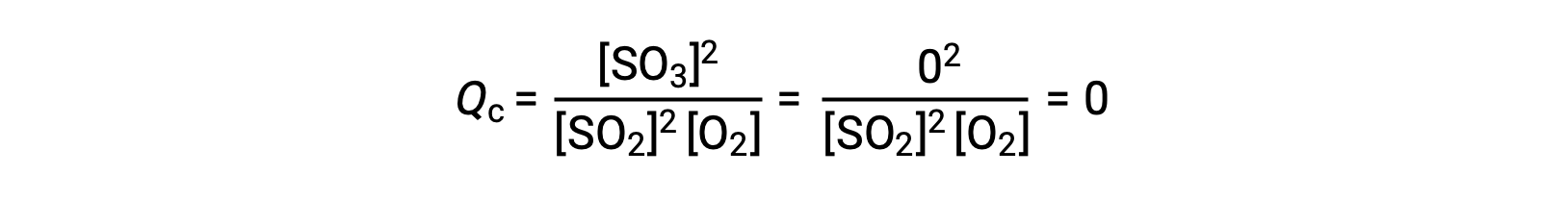
По мере того как реакция движется к равновесию в прямом направлении, концентрации реагент уменьшаются (как и знаменатель КК), концентрация продукта увеличивается (как и числитель КК), и соответственно возрастает коэффициент реакции. При достижении равновесия концентрации реагенты и продуктов остаются неизменными, как и значение КК.
Если реакция начинается только с продукта, значение КК изначально не определено (неизмеримо большое или бесконечное):
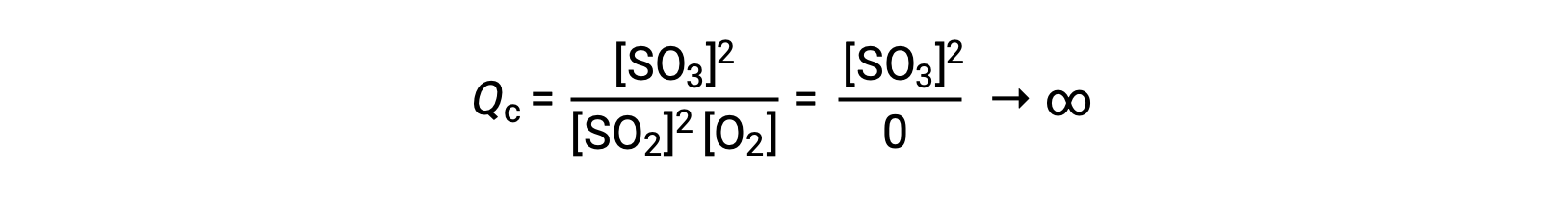
В этом случае реакция идет на равновесие в обратном направлении. Концентрация продукта и числитель КК со временем уменьшаются, концентрации реагент и знаменатель КК увеличиваются, и соответственно коэффициент реакции уменьшается до тех пор, пока он не станет постоянным в равновесии.
Этот текст адаптирован из Openstax, Химия 2е изд., Chapter 16.4: Free Energy and Openstax, Химия 2е изд., Chapter 13.2: Equilibrium.
