17.9:
تغيرات الطاقة الحرة للحالات الغير قياسية
9,427 Views
•
•
يرتبط تغيير الطاقة الحرة لعملية تحدث مع المواد المتفاعلة والمنتجات الموجودة في ظروف غير قياسية (ضغوط بخلاف 1 بار؛ التركيزات بخلاف 1 متر) بالتغير القياسي في الطاقة الحرة وفقًا لهذه المعادلة:
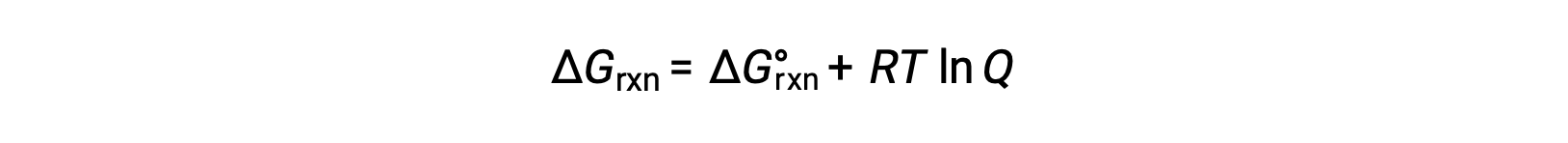
حيث R هو ثابت الغاز (8.314 J/K·mol)، و T هو درجة الحرارة المطلقة بالكلفن، و Q هو حاصل قسمة التفاعل. يمكن استخدام هذه المعادلة للتنبؤ بعفوية العملية تحت أي مجموعة معينة من الشروط.
حاصل قسمة التفاعل (Q)
يتم تقييم حالة التفاعل القابل للعكس بشكل ملائم من خلال تقييم حاصل قسمة التفاعل، Q. لتفاعل قابل للعكس موصوف بواسطة
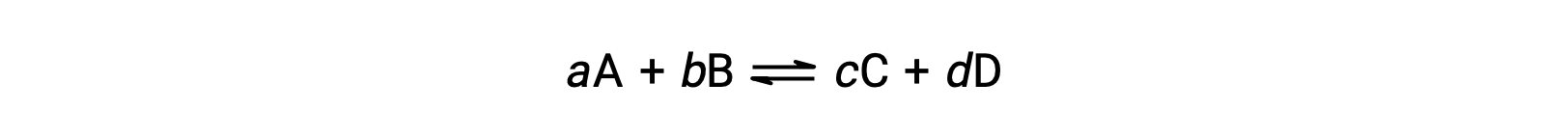
يُشتق حاصل قسمة التفاعل مباشرةً من القياس المتكافئ للمعادلة المتوازنة
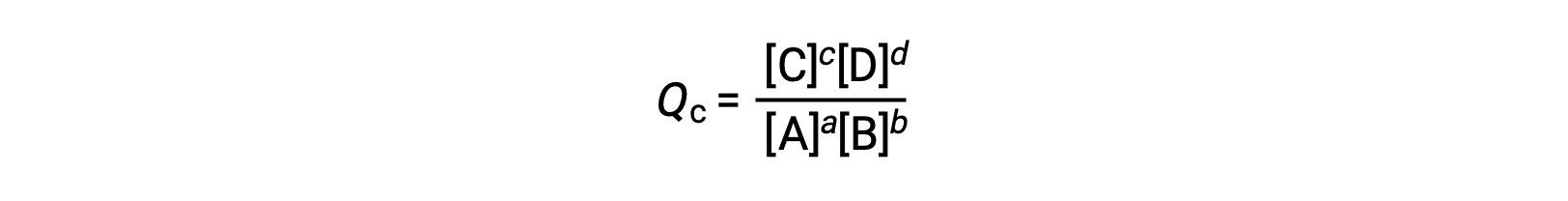
حيث يشير الرمز c إلى استخدام التركيزات المولية في التعبير. حاصل قسمة التفاعل المعتمد على التركيز، Qc، يستخدم لتوازن الطور المكثف. إذا كانت المواد المتفاعلة والمنتجات غازية ، فيمكن اشتقاق حاصل التفاعل بالمثل باستخدام الضغوط الجزئية:
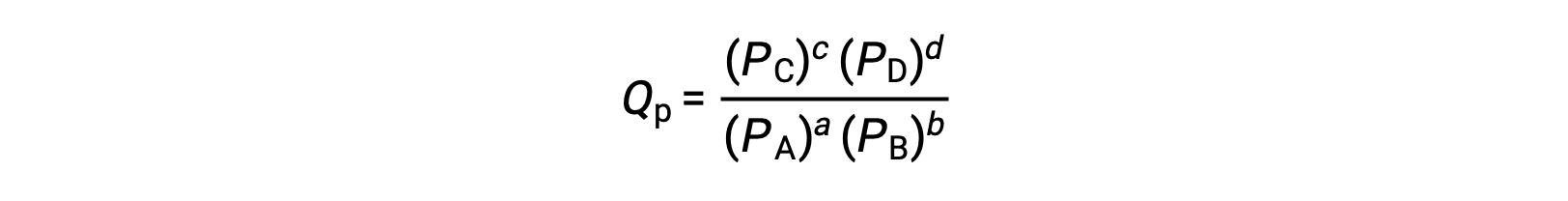
في ظل الظروف القياسية ، تكون تركيزات المادة المتفاعلة ومحلول المنتج 1 م، أو ضغط الغازات 1 بار، و Q يساوي 1. لذل ، في ظل الظروف القياسية
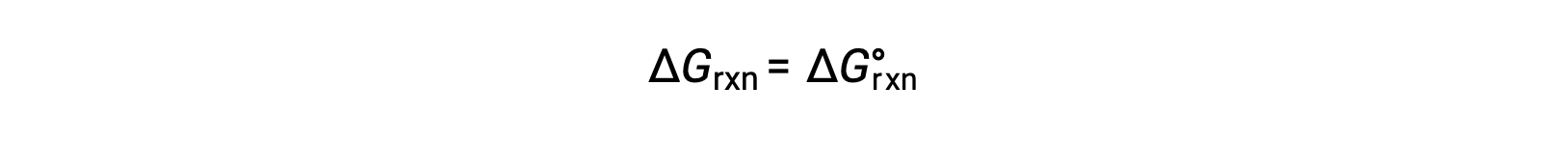
في ظل ظروف غير قياسية، يجب حساب Q.
تختلف القيمة العددية لـ Q مع تقدم التفاعل نحو التوازن؛ لذلك، يمكن أن يكون بمثابة مؤشر مفيد لحالة التفاعل’. لتوضيح هذه النقطة، ضع في اعتبارك أكسدة ثاني أكسيد الكبريت:
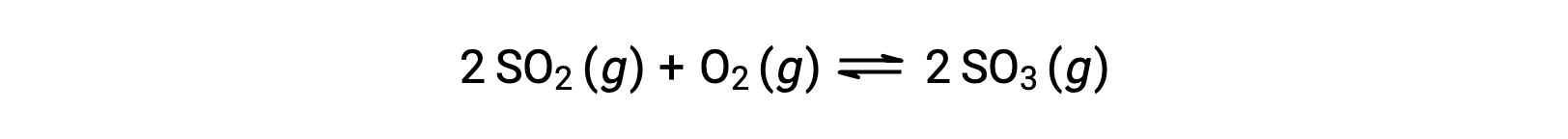
ضع في اعتبارك سيناريوهين تجريبيين مختلفين، أحدهما يبدأ فيه هذا التفاعل بمزيج من المواد المتفاعلة فقط، SO2 and O2، والآخر يبدأ بـ المنتج، SOSO3. بالنسبة للتفاعل الذي يبدأ بخليط من المواد المتفاعلة فقط، فإن Q تساوي في البداية صفرًا:
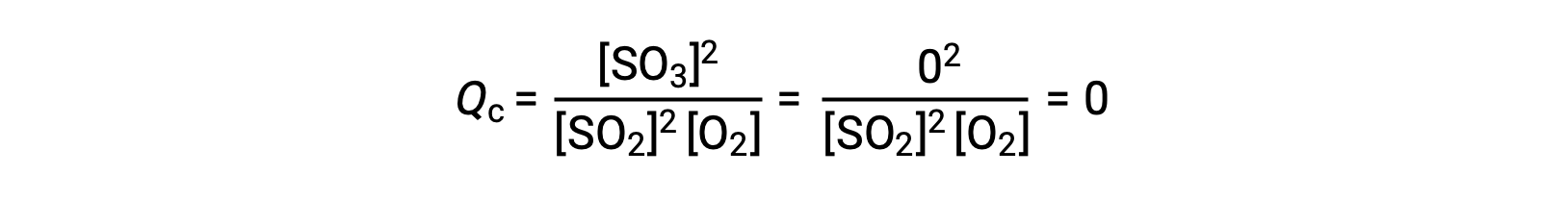
مع تقدم التفاعل نحو التوازن في الاتجاه الأمامي، تنخفض تركيزات المادة المتفاعلة (كما يفعل المقام الحسابي Qc) ، ويزداد تركيز المنتج (كما يفعل البسط الحسابيQc)، وبالتالي يزيد حاصل التفاعل. عند تحقيق التوازن، تظل تركيزات المواد المتفاعلة والنواتج ثابتة، كما هو الحال مع قيمةQc.
إذا بدأ التفاعل بالمنتج الموجود فقط، فإن قيمة Qc تكون في البداية غير محددة (كبيرة أو غير محدودة بشكل لا يقاس):
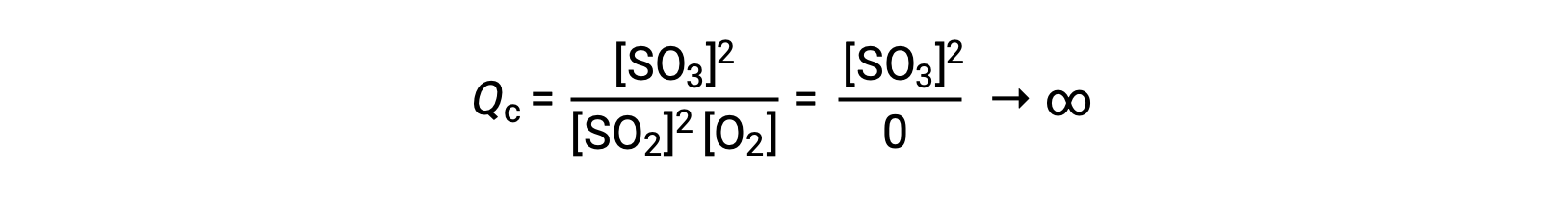
في هذه الحالة، يتقدم التفاعل نحو التوازن في الاتجاه العكسي. تركيز المنتج والبسط الحسابي Qc يتناقصان بمرور الوقت، وتركيزات المادة المتفاعلة والمقام الحسابي Qc يزدادان، وبالتالي ينخفض حاصل التفاعل حتى يصبح ثابتًا عند التوازن.
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 16.4: Free Energy and Openstax, Chemistry 2e, Chapter 13.2: Equilibrium Constants.
