16.8:
Indicadores
38,912 Views
•
•
Ciertas sustancias orgánicas cambian de color en una solución diluida cuando la concentración de iones hidronio alcanza un valor determinado. Por ejemplo, la fenolftaleína es una sustancia incolora en cualquier solución acuosa con una concentración de iones hidronio superior a 5,0 × 10−9 M (pH < 8,3). En soluciones más básicas en las que la concentración de iones hidronio es inferior a 5,0 × 10−9 M (pH > 8,3), es de color rojo o rosa. Las sustancias como la fenolftaleína, que se pueden utilizar para determinar el pH de una solución, se denominan indicadores ácido-base. Los indicadores ácido-base son ácidos orgánicos débiles o bases orgánicas débiles.
El equilibrio en una solución del indicador ácido-base naranja de metilo, un ácido débil, puede ser representado por una ecuación en la que usamos HIn como una representación simple para la molécula compleja de naranja de metilo:
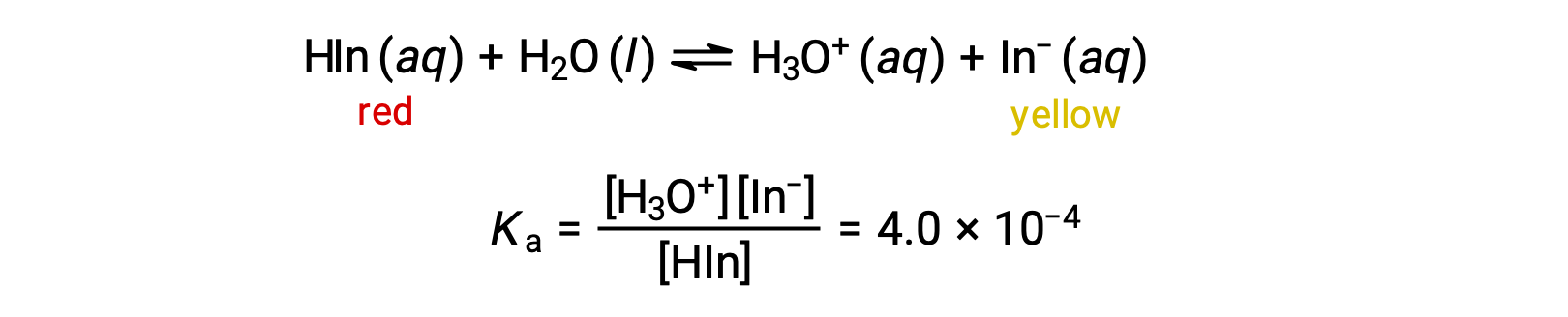
El anión de naranja de metilo, In−, es amarillo, y la forma no ionizada, HIn, es roja. Cuando añadimos ácido a una solución de naranja de metilo, el aumento de la concentración de iones hidronio desplaza el equilibrio hacia la forma roja no ionizada, de acuerdo con el principio de Le Châtelier. Si agregamos una base, cambiamos el equilibrio hacia la forma amarilla. Este comportamiento es completamente análogo a la acción de los amortiguadores.
El color percibido de una solución indicadora está determinado por la relación de las concentraciones de las dos especies In− y HIn. Si la mayor parte del indicador (normalmente alrededor del 60−90% o más) está presente como In−, la solución será de color amarillo. Si la mayoría está presente como HIn, entonces el color de la solución será rojo. La ecuación de Henderson-Hasselbalch es útil para comprender la relación entre el pH de una solución indicadora y su composición (por lo tanto, el color percibido):
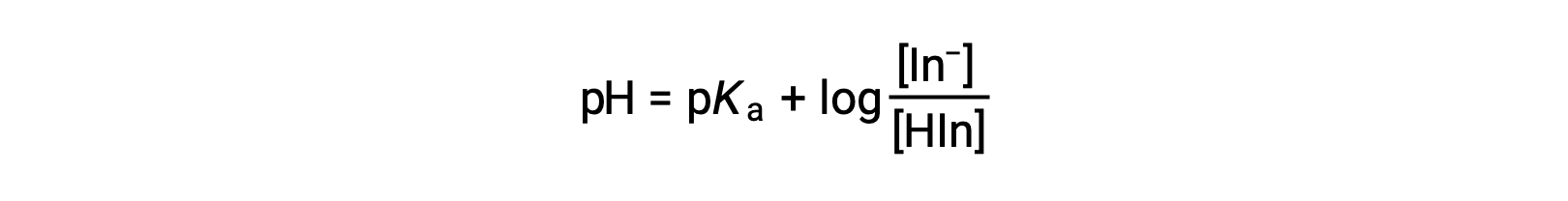
En soluciones donde el pH > pKa, el término logarítmico debe ser positivo, indicando un exceso de la base conjugada del indicador (solución amarilla). Cuando el pH < pKa, el término logarítmico debe ser negativo, indicando un exceso del ácido conjugado (solución roja). Cuando el pH de la solución está cerca del pKa del indicador, hay cantidades apreciables de ambos conjugados y el color de la solución es el de una combinación aditiva de cada uno (amarillo y rojo, produciendo naranja). El intervalo de cambio de color (o intervalo de pH) para un indicador ácido-base se define como el intervalo de valores de pH sobre el que se observa un cambio de color, y para la mayoría de los indicadores este intervalo es aproximadamente el pKa ± 1.
Hay muchos indicadores ácido-base diferentes que cubren una amplia gama de valores de pH y se pueden utilizar para determinar el pH aproximado de una solución desconocida mediante un proceso de eliminación. Los indicadores universales y el papel de pH contienen una mezcla de indicadores y muestran diferentes colores en diferentes pH.
Este texto es adaptado de Openstax, Química 2e, Sección 14.7: Titulaciones ácido-base.
