15.2:
Кислотно-щелочная сила и константы диссоциации
53,124 Views
•
•
Относительная прочность кислоты или основание – это степень ее ионизации при растворении в воде. Если ионизационная реакция по существу завершена, кислота или основание называют сильной; если происходит относительно небольшая ионизация, кислота или основание слабы. Существует гораздо больше слабых кислот и оснований, чем сильных. Ниже перечислены наиболее распространенные сильные кислоты и основания:
| Сильные кислоты | Сильное основание |
| HClO4 | LiOH |
| HCl | NaOH |
| HBr | KOH |
| HI | Ca(OH)2 |
| HNО3 | Sr(OH)2 |
| H2SO4 | Ba(OH)2 |
Относительные сильные стороны кислот можно количественно оценить, измерив их константы равновесия в водных растворах. В растворах той же концентрации более сильные кислоты ионизируются в большей степени и, таким образом, дают более высокую концентрацию ионов гидрония, чем более слабые кислоты. Константа равновесия для кислоты называется константой кислотоионизации, Ка. Для реакции кислоты HA:
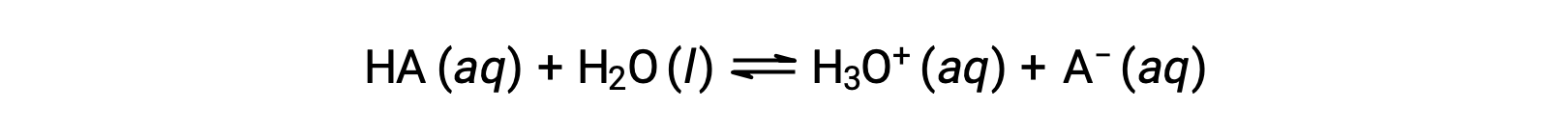
константа ионизации кислоты записывается как
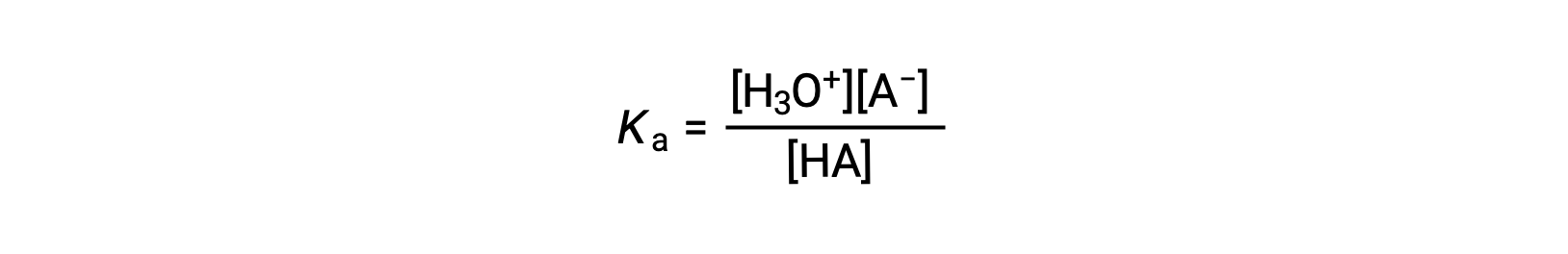
где концентрации находятся в равновесии. Несмотря на то, что вода является реагент в реакции, она также является растворителем, поэтому мы не включаем [H2O] в уравнение. Чем больше Ка кислоты, тем больше концентрация H3O+ и A– относительно концентрации неионизированной кислоты, ГК, в равновесной смеси, и тем сильнее кислота. Кислота классифицируется как «сильная», когда она подвергается полной ионизации, в этом случае концентрация ГК равна нулю, а константа ионизации кислоты неизмеримо велика (Ka ≈ ∞). Частично ионизированные кислоты называются “слабыми”, и их константы ионизации кислоты могут быть экспериментально измерены.
Чтобы проиллюстрировать эту идею, ниже показаны три уравнения ионизации кислоты и значения Ка. Константы ионизации увеличиваются с первого до последнего из перечисленных уравнений, указывая на увеличение относительной кислотной силы в порядке CH3CO2H < HNО2 < HSO4–.
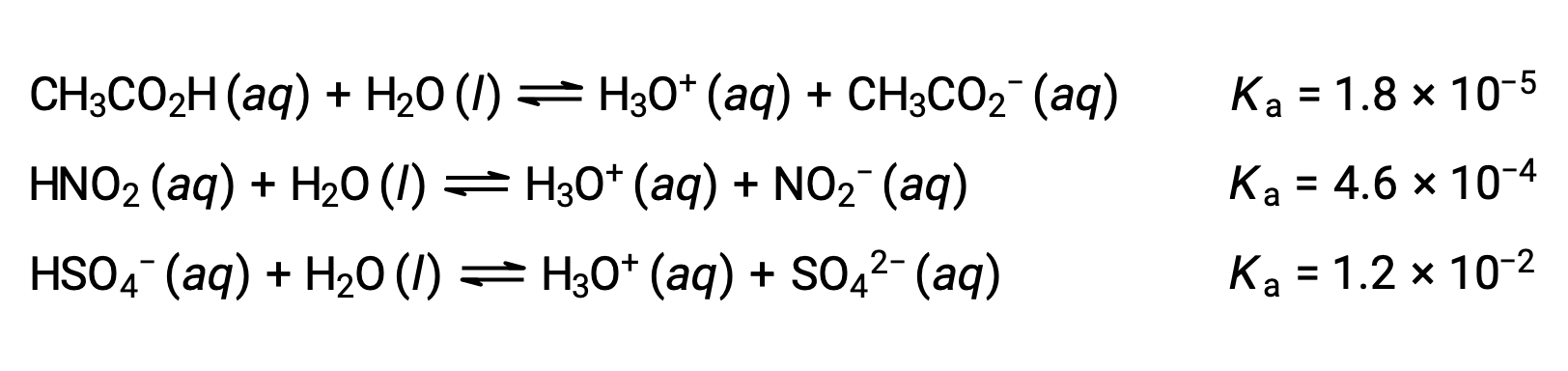
Другой мерой силы кислоты является ее процентная ионизация. Процентная ионизация слабой кислоты определяется по составу равновесной смеси:
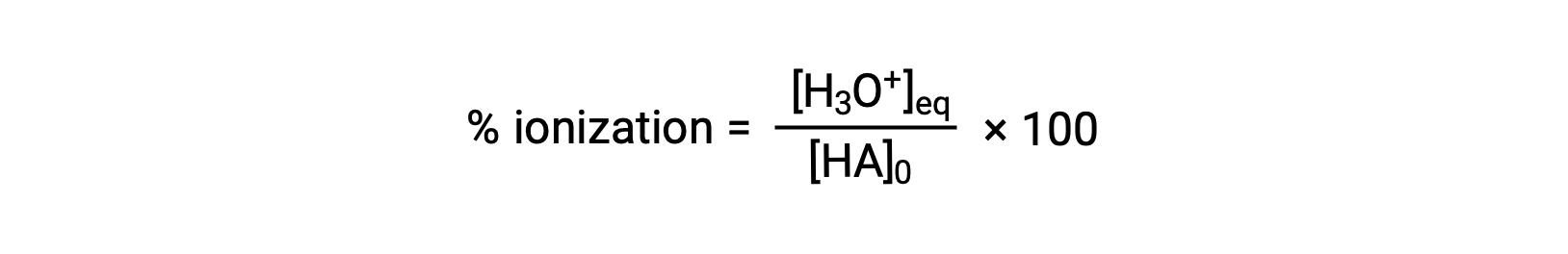
Где числитель эквивалентен концентрации конъюгата кислоты основание (по стехиометрии, [A–] = [H3O+]). В отличие от значения Ка, процентная ионизация слабой кислоты меняется с начальной концентрацией кислоты, обычно уменьшающейся по мере увеличения концентрации.
Так же, как и кислоты, относительная прочность основание отражается в величине его константы базовой ионизации (Kb) в водных растворах. В растворах с такой же концентрацией более сильные основания ионируют в большей степени, и таким образом дают более высокую концентрацию ионов гидроксида, чем более слабые основания. Более сильный основание имеет большую константу ионизации, чем более слабый основание. Для реакции основание, B:
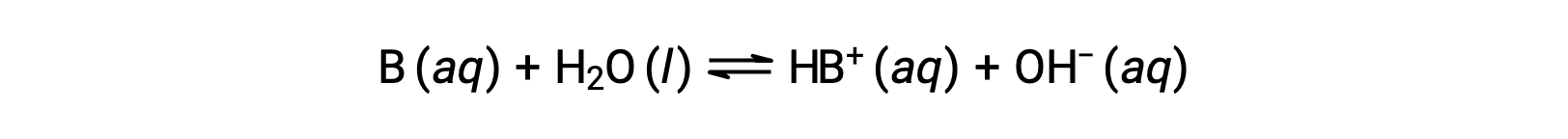
константа ионизации записывается как
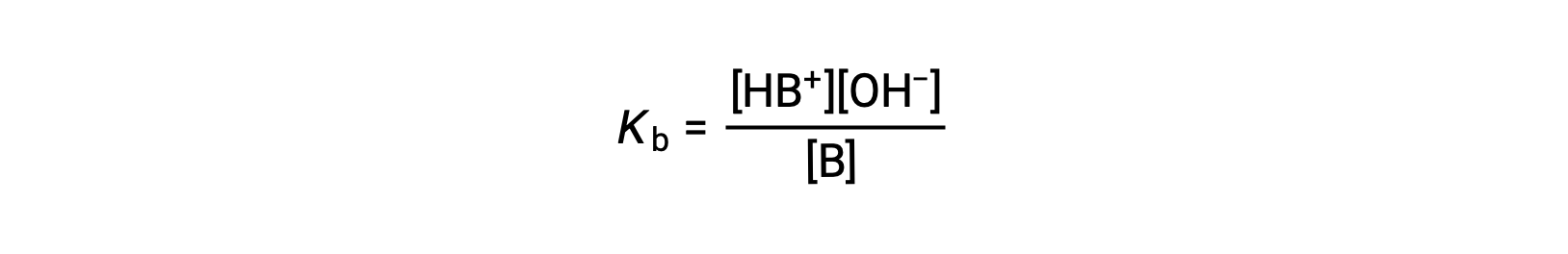
Проверка данных по трем слабым основаниям, представленная ниже, показывает, что сила основание увеличивается в порядке NО2– < CH2 CO2– < NH3.
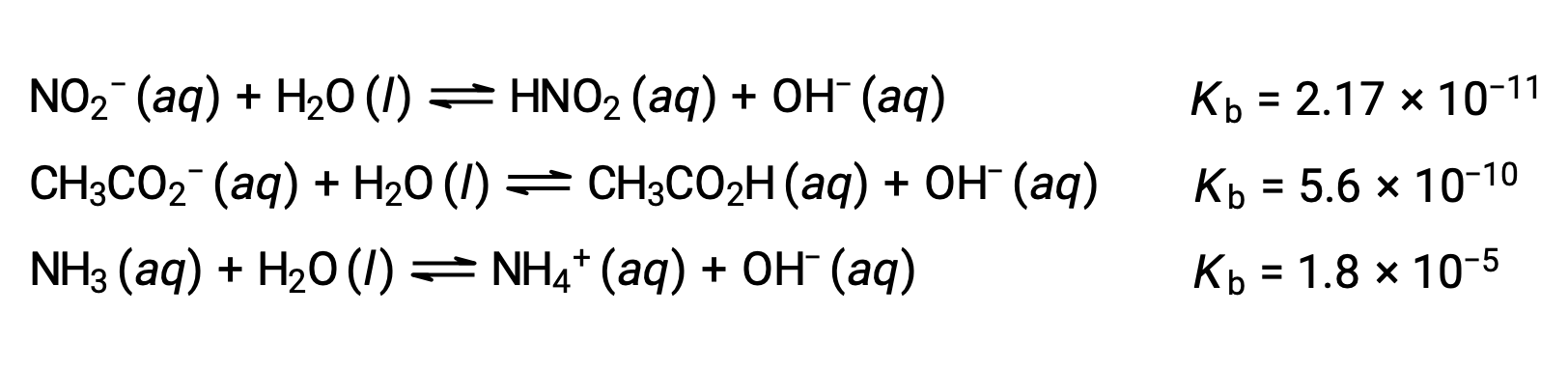
Что касается кислот, относительная сила основание также отражается в его процентной ионизации, вычисленной как
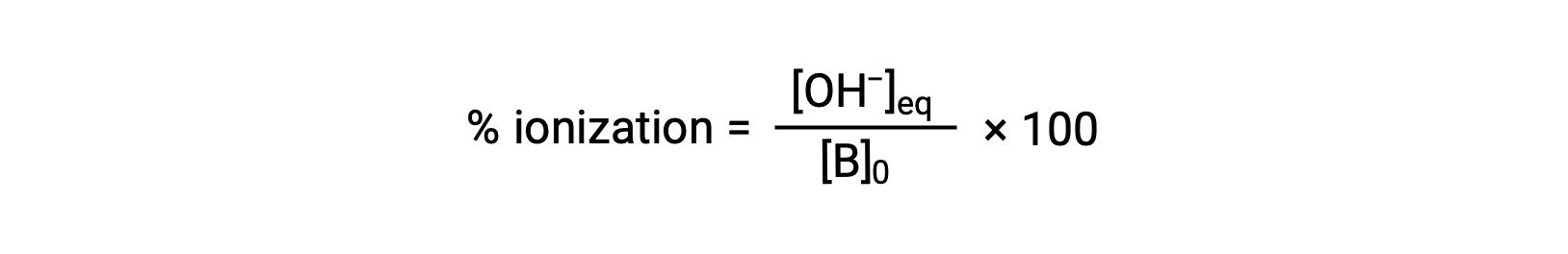
но будет меняться в зависимости от константы ионизации основание и начальной концентрации раствор.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.3: Относительные силы кислот и оснований.
