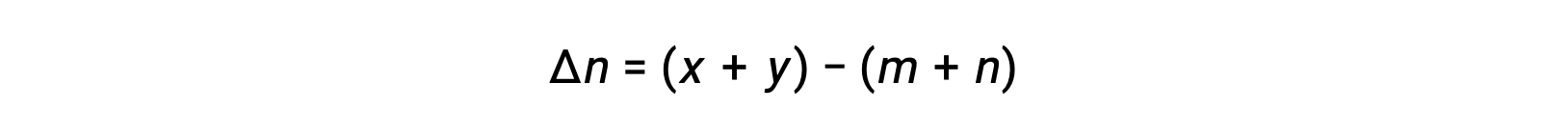14.3:
기체 반응과 불균일계 반응의 평형
É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
JoVE Core
Química
Homogeneous Equilibria for Gaseous Reactions
20,604 Views
•
02:15 min
•
September 24, 2020
기체 반응을 위한 동질적인 평형
가스상 반응의 경우, 평형 상수는 반응제 및 제품의 어금니농도(Kc)또는 부분 압력(Kp)의관점에서 발현될 수 있다. 이 두 K 값 간의 관계는 단순히 이상적인 가스 방정식과 어금니정의 정의에서 파생될 수 있습니다. 이상적인 가스 방정식에 따르면:
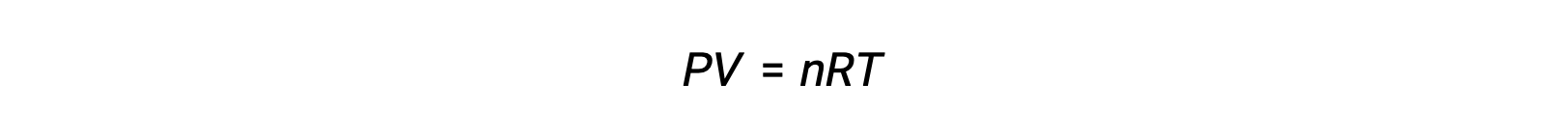
어금니 농도 또는 어모는 볼륨으로 나눈 두더지의 수에 의해 주어집니다:
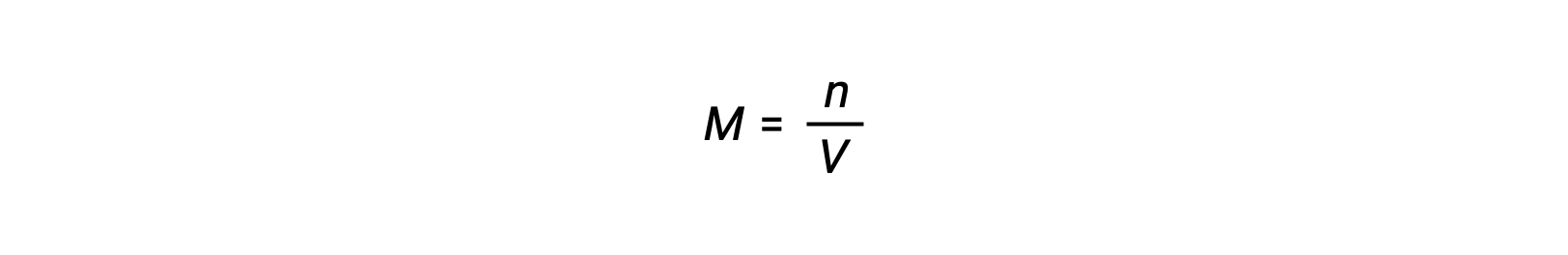
따라서
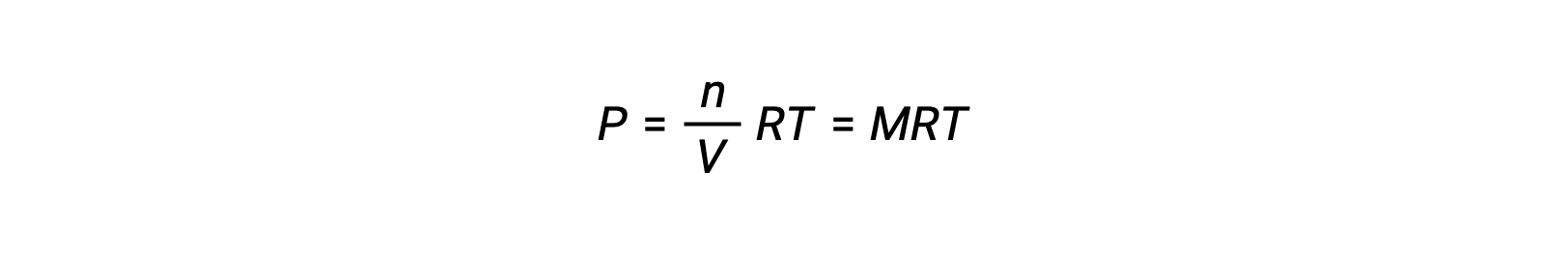
P가 부분압력인 경우, V는 부피이고, n은 두더지의 수이고, R은 가스 상수, T는 온도이고, M은 어금니 농도이다.
가스 상 반응: m A + n B ⇌ x C + y D
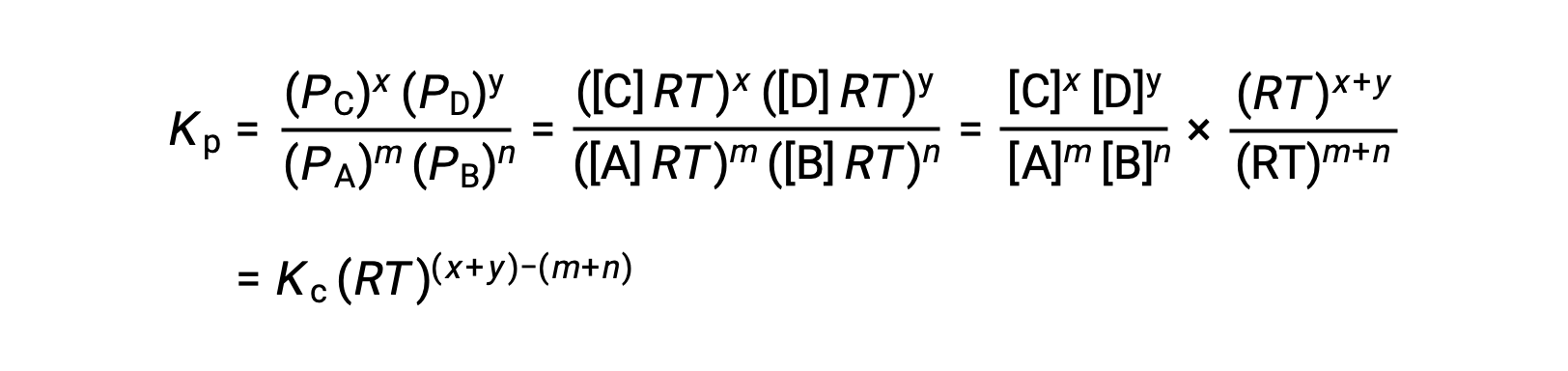
그래서KC와 KP의 관계는
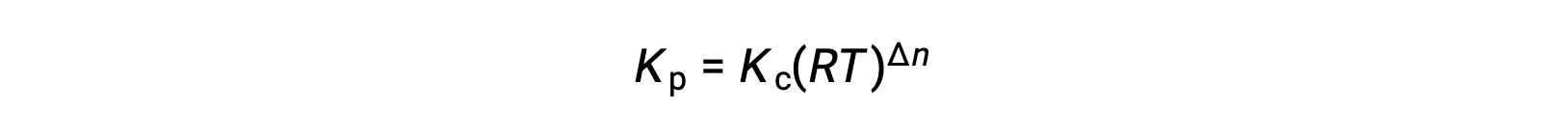
여기서 Δn은 제품 및 반응제 가스의 어금다량의 차이입니다.