13.3:
Concentration et loi des vitesses de réaction
23,534 Views
•
•
La vitesse d’une réaction est influencée par les concentrations de réactifs. Les lois de vitesse (lois de vitesse différentielles) ou équations de vitesse sont des expressions mathématiques décrivant la relation entre la vitesse d’une réaction chimique et la concentration de ses réactifs.
Par exemple, dans une réaction générale aA + bB ⟶ produits, où a et b sont des coefficients stœchiométriques, la loi de vitesse peut être écrite comme suit :
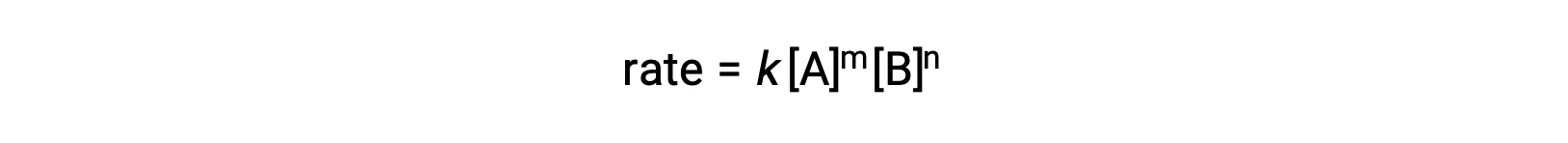
[A] et [B] représentent les concentrations molaires des réactifs, et k est la constante de vitesse, qui est spécifique à une réaction particulière à une température précise.
Les exposants m et n sont les ordres de la réaction et sont généralement des nombres entiers positifs, bien qu’ils puissent être des fractions, négatifs ou nuls.
La constante de vitesse k et les ordres de réaction m et n sont déterminés expérimentalement en observant comment la vitesse d’une réaction varie au fur et à mesure que les concentrations des réactifs changent. La constante de vitesse k est indépendante des concentrations de réactifs, mais varie en fonction de la température.
Les ordres de réaction dans une loi de vitesse décrivent la dépendance mathématique entre la vitesse et les concentrations de réactifs. En se référant à la loi de vitesse générale (vitesse = k[A]m[B]n), la réaction est d’ordre m par rapport à A et d’ordre n par rapport à B. Par exemple, si m = 1 et n = 2, la réaction est du premier ordre pour A et du deuxième ordre pour B. L’ordre global de la réaction est simplement la somme des ordres pour chaque réactif. Pour l’exemple de la loi de vitesse ici, la réaction est du troisième ordre globalement (1 + 2 = 3).
Une approche expérimentale courante pour la détermination des lois de vitesse est la méthode des vitesses initiales. Cette méthode consiste à mesurer les vitesses de réaction pour de multiples essais expérimentaux réalisés en utilisant différentes concentrations initiales de réactifs. La comparaison des vitesses mesurées pour ces essais permet de déterminer les ordres de réaction et, par la suite, la constante de vitesse, qui conjointement servent à formuler une loi de vitesse.
Les lois de vitesse peuvent présenter des ordres fractionnaires pour certains réactifs, et des ordres de réaction négatifs sont parfois observés lorsqu’une augmentation de la concentration d’un réactif entraîne une diminution de la vitesse de réaction. Il est important de noter que les lois de vitesse sont déterminées expérimentalement seulement et ne sont pas prédites de façon fiable d’après la stœchiométrie de la réaction.
L’ordre de la réaction détermine la relation entre la vitesse de réaction et la concentration des réactifs ou des produits.
• Dans une réaction d’ordre zéro, la concentration des réactifs n’a aucun effet sur la vitesse de la réaction, qui reste constante tout le long.
• Dans une réaction de premier ordre, la vitesse de réaction est directement et linéairement proportionnelle à la variation de la concentration du réactif. Au fur et à mesure que la concentration du réactif diminue, la vitesse de réaction diminue également de façon proportionnelle.
• Dans les réactions de deuxième ordre ou d’un ordre supérieur, la vitesse de réaction est proportionnelle à la valeur exponentielle des réactifs. Par conséquent, à mesure que la réaction progresse et que la concentration des réactifs diminue, la vitesse de réaction diminue de façon exponentielle.
Ce texte est adapté de Openstax, Chimie 2e, Section 12.3 : Lois de vitesse.
