13.1:
Velocidad de Reacción
41,714 Views
•
•
La velocidad de reacción es el cambio en la cantidad de un reactivo o producto por unidad de tiempo. Por lo tanto, las velocidades de reacción se determinan midiendo la dependencia del tiempo de alguna propiedad que puede estar relacionada con las cantidades de reactivo o producto. Las velocidades de reacciones que consumen o producen sustancias gaseosas, por ejemplo, se determinan convenientemente midiendo los cambios de volumen o presión.
La representación matemática del cambio en la concentración de reactivos y productos, a lo largo del tiempo, es la expresión de la velocidad de la reacción. Los corchetes indican las concentraciones molares y el símbolo delta (Δ) indica “cambio”.
Por ejemplo, la concentración de peróxido de hidrógeno, H2O2, en una solución acuosa cambia lentamente con el tiempo a medida que se descompone según la ecuación:
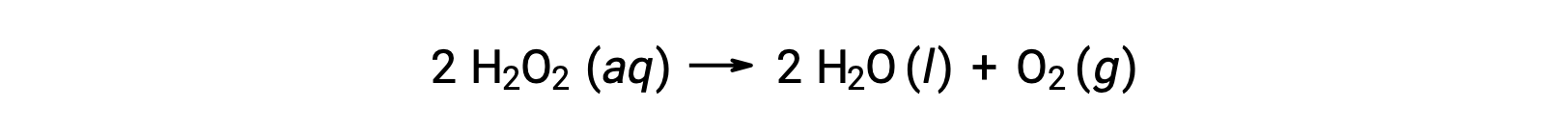
La velocidad a la que se descompone el peróxido de hidrógeno puede expresarse en términos de la velocidad de cambio de su concentración:

Así, [H2O2]t1 representa la concentración molar del peróxido de hidrógeno en el tiempo t1; del mismo modo, [H1O2]t2 representa la concentración molar del peróxido de hidrógeno en un momento posterior t2; y Δ[H2O2] representa el cambio en la concentración molar del peróxido de hidrógeno durante el intervalo de tiempo Δt (es decir, t2 − t1). Dado que la concentración de reactivo disminuye a medida que la reacción avanza, Δ[H2O2] es una cantidad negativa. Las velocidades de reacción son, por convención, cantidades positivas, por lo que este cambio negativo en la concentración se multiplica por −1.
Velocidad de reacción media y velocidad de reacción instantánea
Las velocidades de reacción varían con el tiempo y disminuyen a medida que avanza la reacción. Se puede calcular una velocidad de reacción media durante un intervalo de tiempo utilizando las concentraciones al principio y al final de este período, durante las cuales la velocidad de reacción está cambiando. En cualquier momento específico, la velocidad a la que está procediendo una reacción se conoce como su velocidad instantánea. La velocidad instantánea de una reacción en “tiempo cero”, cuando comienza la reacción, es su velocidad inicial.
La velocidad instantánea de una reacción puede ser determinada por una de las dos maneras. Si las condiciones experimentales permiten la medición de los cambios de concentración en intervalos de tiempo cortos, el cálculo de las velocidades medias proporciona aproximaciones razonablemente buenas de las velocidades instantáneas. Alternativamente, se puede utilizar un procedimiento gráfico. Por ejemplo, en el ejemplo de descomposición del peróxido de hidrógeno, al graficar la concentración de peróxido de hidrógeno frente al tiempo, la velocidad instantánea de descomposición del H2O2 puede calcularse en cualquier momento ‘t’ desde la pendiente de una tangente trazada a la curva en ese momento.
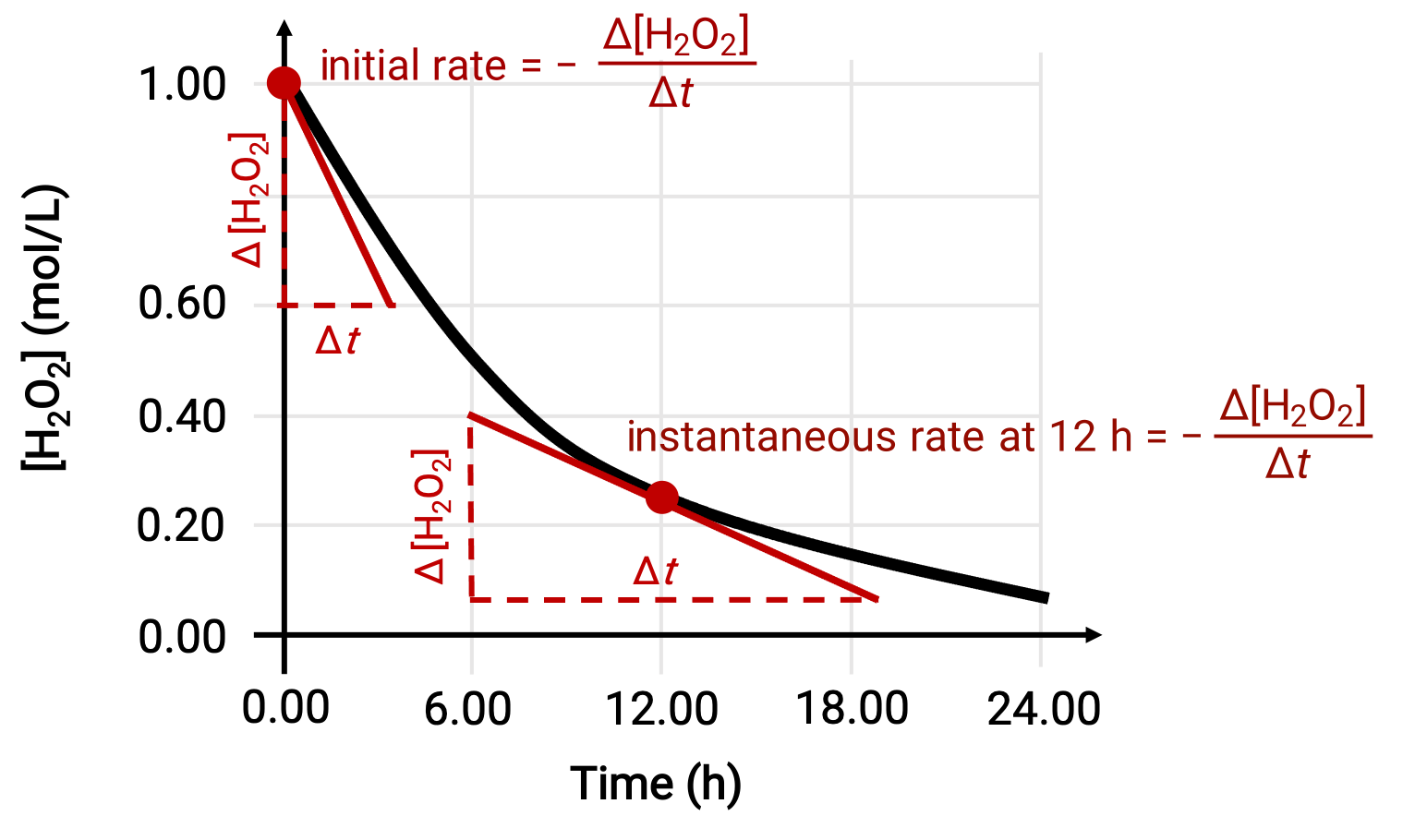
Este es un gráfico de la concentración frente al tiempo para una solución de H2O2 de 1.000 M. La velocidad en cualquier momento es igual al negativo de la pendiente de una línea tangente a la curva en ese momento. Las tangentes se muestran en t = 0 h (“velocidad inicial”) y en t = 12 h (“velocidad instantánea” a 12 h).
Velocidades relativas de reacción
La velocidad de una reacción puede expresarse como el cambio en la concentración de cualquier reactivo o producto. Para cualquier reacción dada, estas expresiones de velocidad están todas relacionadas entre sí según la estequiometría de la reacción. La velocidad de la reacción general aA ⟶ bB puede expresarse en términos de la disminución de la concentración de A o el aumento de la concentración de B. Estas dos expresiones de velocidad están relacionadas por la estequiometría de la reacción, donde:
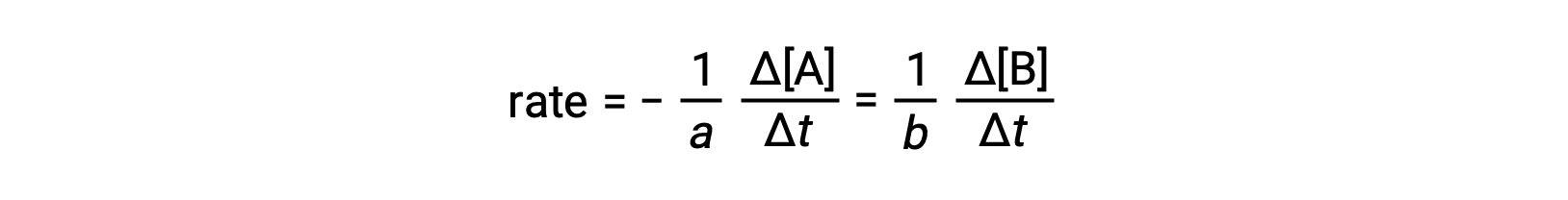
Tenga en cuenta que se ha incluido un signo negativo como factor para tener en cuenta los signos opuestos de los dos cambios de cantidad (la cantidad de reactivo disminuye mientras que la cantidad de producto aumenta).
Este texto es adaptado de Openstax, Química 2e, Capítulo 12 Introducción y Openstax, Química 2e, Sección 12.1: Velocidades de reacción química.
