11.17:
Solidi metallici
16,256 Views
•
•
Solidi metallici come cristalli di rame, alluminio e ferro sono formati da atomi metallici. La struttura dei cristalli metallici è spesso descritta come una distribuzione uniforme dei nuclei atomici all’interno di un “mare” di elettroni delocalizzati. Gli atomi all’interno di un tale solido metallico sono tenuti insieme da una forza unica nota come incollaggio metallico che dà origine a molte proprietà di massa utili e varie.
Tutti i solidi metallici presentano un’elevata conduttività termica ed elettrica, lucentezza metallica e malleabilità. Molti sono molto duri e abbastanza forti. A causa della loro malleabilità (la capacità di deformarsi sotto pressione o martellamento), non si frantumano e, quindi, rendono utili materiali da costruzione. I punti di fusione dei metalli variano ampiamente. Il mercurio è un liquido a temperatura ambiente e i metalli alcalini si sciolgono al di sotto dei 200 °C. Diversi metalli post-transizione hanno anche bassi punti di fusione, mentre i metalli di transizione si sciolgono a temperature superiori a 1000 °C. Queste differenze riflettono le differenze nei punti di forza dell’incollaggio metallico tra i metalli.
Proprietà dei solidi metallici
A causa della loro struttura cristallina, i solidi metallici mostrano poche proprietà uniche associate alla struttura e sono stati tabulati nella tabella seguente.
| Tipo di solido | Tipo di particelle | Tipo di attrazioni | Proprietà | Esempi |
| Metallici | Atomi di elementi elettropositivi | Legami metallici | lucido, malleabile, duttile, conduce bene calore ed elettricità, durezza variabile e temperatura di fusione | Cu, Fe, Ti, Pb, U |
Struttura cristallina dei solidi metallici: imballaggio ravvicinato
I solidi fatti di atomi identici possono avere due tipi di arrangiamenti: quadrati o stretti (Figura 1). Poiché l’imballaggio ravvicinato massimizza le attrazioni complessive tra gli atomi e riduce al minimo l’energia intermolecolare totale, gli atomi nella maggior parte dei metalli si impacchettono in questo modo.

Figura 1. Disposizione quadrata e stretta.
Troviamo due tipi di imballaggio più vicino in semplici strutture cristalline metalliche: l’imballaggio esagonale più vicino (HCP) e l’imballaggio cubico più vicino (CCP). Entrambi consistono in strati ripetuti di atomi disposti esagonalmente. In entrambi i tipi, un secondo strato (B) viene posizionato sul primo strato (A) in modo che ogni atomo nel secondo strato sia in contatto con tre atomi nel primo strato. Il terzo livello è posizionato in due modi.
In HCP, gli atomi nel terzo strato sono direttamente sopra gli atomi nel primo strato (cioè, il terzo strato è anche un tipo A), e l’impilamento è costituito da strati alternati di tipo A e tipo B impacchettati (cioè ABABAB⋯) (Figura 2a).
In CCP, gli atomi nel terzo strato non sono al di sopra degli atomi in uno dei primi due strati (cioè, il terzo strato è di tipo C), e l’impilamento è costituito da livelli alternati di tipo A, tipo B e tipo C a pacco ravvicinato (ad esempio, ABCABCABC⋯) (Figura 2b). Le disposizioni cubiche centrato sulla faccia (FCC) e CCP sono in realtà le stesse strutture con impacchettamento compatto di atomi, che occupano il 74% del volume.
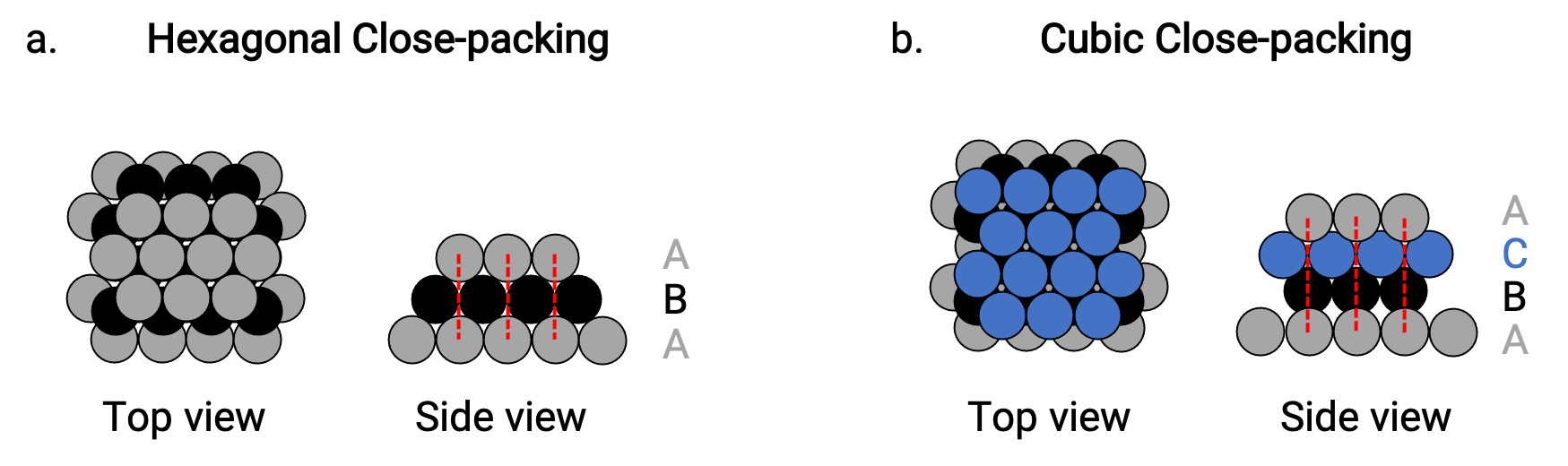
Figura 2. (a) L’imballaggio ravvicinato esagonale è costituito da due strati alternati (ABABAB…). (b) L’imballaggio cubico a chiusura è costituito da tre strati alternati (ABCABCABC…).
In entrambi i tipi di impacchettamento, ogni atomo contatta sei atomi nel proprio strato, tre nello strato sopra e tre nello strato sottostante. Quindi ogni atomo tocca 12 vicino ai vicini e quindi ha un numero di coordinazione di 12.
Circa due terzi di tutti i metalli cristallizzano in array imballati più vicini con numeri di coordinazione di 12. I metalli che cristallizzano in una struttura HCP includono Cd, Co, Li, Mg, Na e Zn, e i metalli che cristallizzano in una struttura CCP includono Ag, Al, Ca, Cu, Ni, Pb e Pt.
Questo testo è stato adattato da Openstax, Chemistry 2e, Sections 10.5 The Solid State of Mattere 10.6 Lattice Structures in Crystalline Solids.
