11.12:
Curvas de Calentamiento y Enfriamiento
19,336 Views
•
•
Cuando una sustancia— aislada de su entorno—se somete a cambios de calor, se observan los cambios correspondientes en la temperatura y fase de la sustancia, representados gráficamente por curvas de calentamiento y enfriamiento.
Por ejemplo, la adición de calor aumenta la temperatura de un sólido; la cantidad de calor absorbido depende de la capacidad calorífica del sólido (q = mcsólidoΔT). Según la termoquímica, la relación entre la cantidad de calor absorbido o liberado por una sustancia, q, y el cambio de temperatura acompañante, ΔT, es:
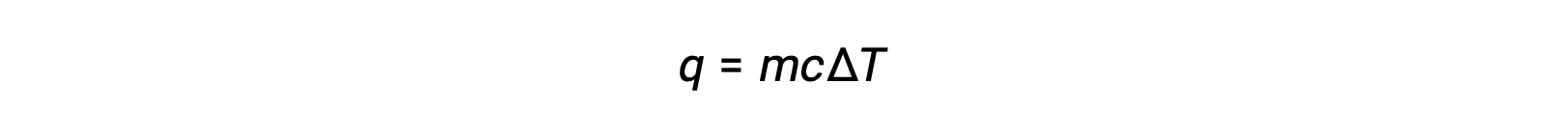
donde m es la masa de la sustancia y c es su calor específico. La relación se aplica a la materia que se está calentando o enfriando, pero no cambiando de estado.
Cuando la temperatura es lo suficientemente alta, el sólido comienza a derretirse (Figura 1, punto A). El calor absorbido depende de la capacidad térmica del sólido (q =mcsólidoΔT) y se observa una meseta en su punto de fusión. La meseta indica un cambio de estado de sólido a líquido, durante el cual la temperatura no aumenta debido al calor de fusión (q =mΔHfusión). En otras palabras, una mayor ganancia de calor es el resultado de la disminución de las atracciones intermoleculares, en lugar de aumentar las energías cinéticas moleculares. En consecuencia, mientras una sustancia está cambiando de estado, su temperatura permanece constante.
Una vez que el sólido se ha fundido completamente (Figura 1, punto B), el líquido comienza a calentarse y experimenta un aumento de temperatura. El calor absorbido depende de la capacidad térmica del líquido (q = mclíquidoΔT). Cuando el líquido alcanza su punto de ebullición, el líquido comienza a evaporarse (Figura 1, punto C) y la temperatura permanece constante a pesar de la continua entrada de calor. Se observa otra meseta (temperatura constante) en el punto de ebullición del líquido durante la transición de líquido a gas debido al calor de vaporización (q = mΔHvap). Esta misma temperatura es mantenida por el líquido mientras esté hirviendo. Si el calor es proporcionado a una mayor velocidad, la temperatura del líquido no aumenta, sino que la ebullición se vuelve más vigorosa (rápida). Después de que todo el líquido se haya vaporizado (Figura 1, punto D), la temperatura del gas aumenta.
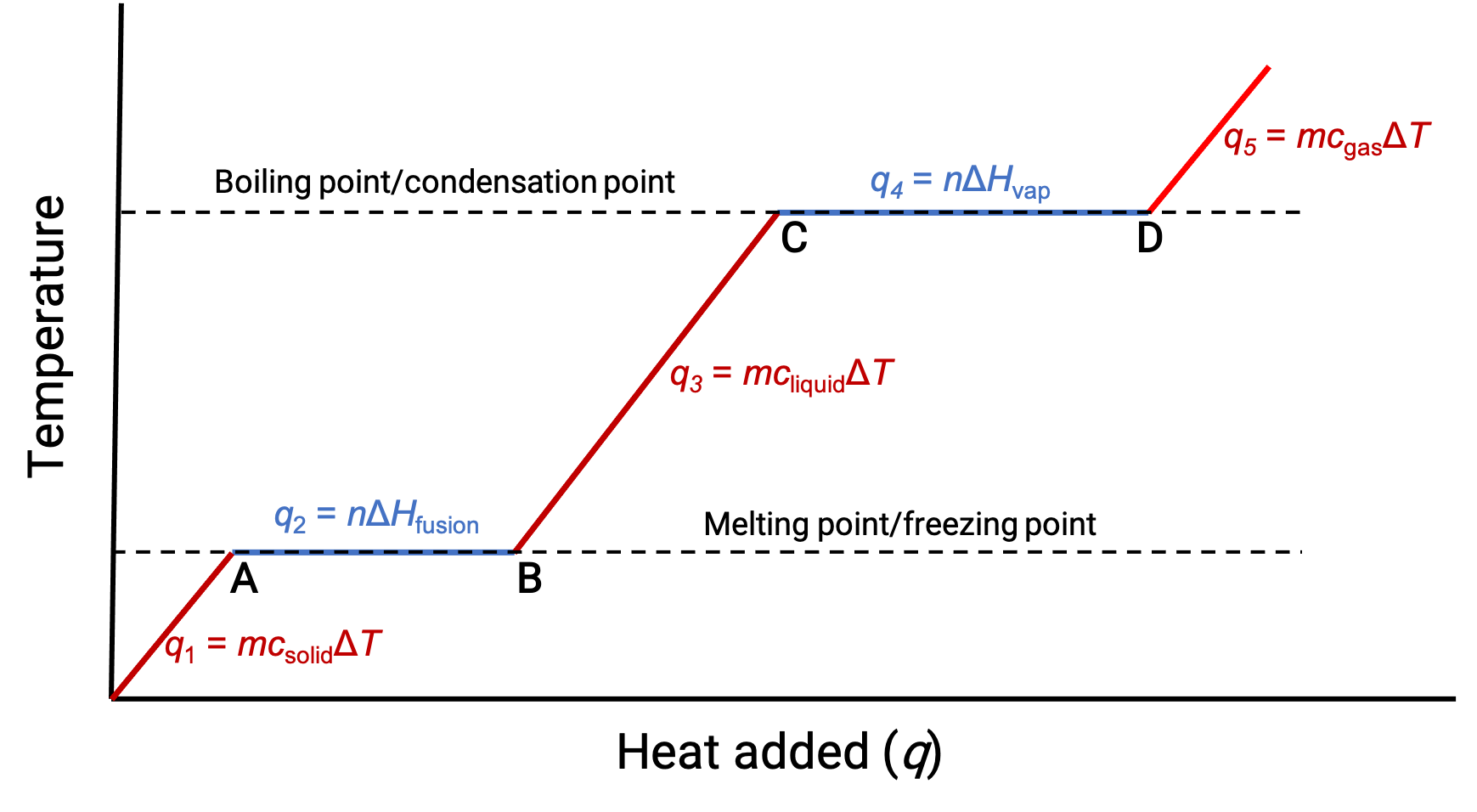
Figura 1. La curva de calentamiento representativa de una sustancia muestra los cambios de temperatura que se producen a medida que la sustancia absorbe cantidades crecientes de calor. Las mesetas de la curva (regiones de temperatura constante) se muestran cuando la sustancia sufre transiciones de fase.
Este texto es adaptado de Openstax, Química 2e, Sección 10.3: Transiciones de Fase.
