11.11:
Transiciones de Fase: Sublimación y Deposición
14,482 Views
•
•
Algunos sólidos pueden pasar directamente al estado gaseoso, pasando por alto el estado líquido, a través de un proceso conocido como sublimación. A temperatura ambiente y presión estándar, un pedazo de hielo seco (CO2 sólido) se sublima, simulando desaparecer gradualmente sin formar ningún líquido. La nieve y el hielo se subliman a temperaturas por debajo del punto de fusión del agua, un proceso lento que puede acelerarse por los vientos y la reducción de las presiones atmosféricas en altitudes elevadas. Cuando el yodo sólido se calienta, el sólido se sublima y se forma un vapor púrpura intenso. El reverso de la sublimación se llama deposición, un proceso en el cual las sustancias gaseosas se condensan directamente en el estado sólido, omitiendo el estado líquido. La formación de escarchas es un ejemplo de deposición.
Al igual que la vaporización, el proceso de sublimación requiere un aporte de energía para superar las atracciones intermoleculares. La sublimación es, por lo tanto, una transición de fase endotérmica. La entalpía de sublimación, ΔHsub, es la energía requerida para convertir un mol de una sustancia del estado sólido al estado gaseoso. Por ejemplo, la sublimación del dióxido de carbono se representa mediante:

Del mismo modo, el cambio de entalpía para el proceso inverso de deposición es igual en magnitud pero opuesto en signo al de la sublimación. Debido a que la deposición implica la formación de fuerzas intermoleculares, es una transición de fase exotérmica.

Considere hasta qué punto deben superarse las atracciones intermoleculares para lograr una transición de fase determinada. Convertir un sólido en un líquido requiere que estas atracciones sean superadas sólo parcialmente; la transición al estado gaseoso requiere que se superen completamente. Como resultado, la entalpía de fusión de una sustancia es menor que su entalpía de vaporización. Esta misma lógica se puede utilizar para obtener una relación aproximada entre las entalpías de todos los cambios de fase de una sustancia determinada. Aunque no es una descripción totalmente precisa, la sublimación puede ser modelada convenientemente como un proceso secuencial de fusión en dos pasos seguido por la vaporización para aplicar la Ley de Hess. Visto de esta manera, la entalpía de sublimación de una sustancia puede ser estimada como la suma de sus entalpías de fusión y vaporización.
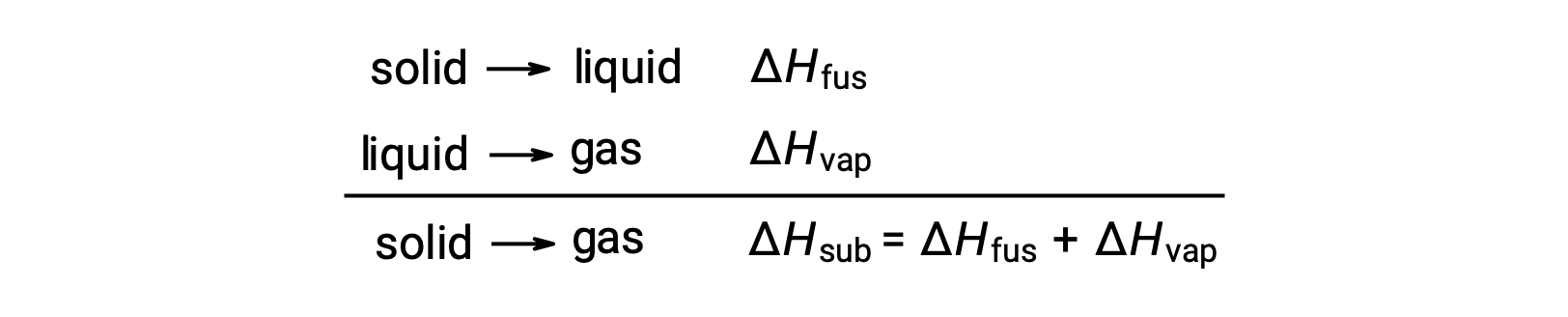
Este texto es adaptado de Openstax, Química 2e, Sección 10.3: Transiciones de Fase.
