9.13:
Energias de Ligação e Tamanhos de Ligação
22,470 Views
•
•
Moléculas estáveis existem porque ligações covalentes mantêm os átomos juntos. A força de uma ligação covalente é medida pela energia necessária para quebrá-la, ou seja, a energia necessária para separar os átomos ligados. Separar qualquer par de átomos ligados requer energia — quanto mais forte uma ligação, maior a energia necessária para quebrá-la.
A energia necessária para quebrar uma ligação covalente específica em um mole de moléculas gasosas é chamada de energia de ligação ou energia de dissociação de ligação. A energia de ligação para uma molécula diatómica, DX–Y, é definida como a alteração da entalpia padrão para a reação endotérmica:
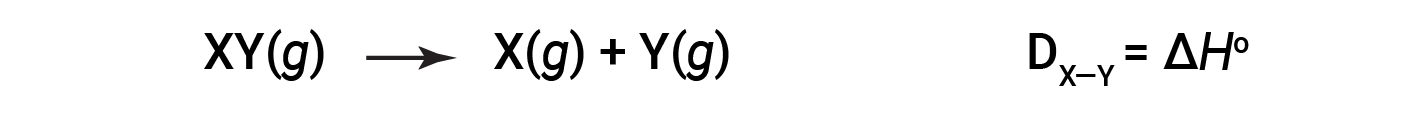
Por exemplo, a energia de ligação da ligação covalente pura H–H, DH–H, é 436 kJ/mol de ligações H–H quebradas:

Moléculas com três ou mais átomos têm duas ou mais ligações. A soma de todas as energias de ligação em uma molécula deste tipo é igual à alteração da entalpia padrão para a reação endotérmica que quebra todas as ligações na molécula. Por exemplo, a soma das quatro energias de ligação C–H em CH4, 1660 kJ, é igual à alteração da entalpia padrão da reação:
A energia de ligação média de C–H, DC–H, é 1660/4 = 415 kJ/mol porque há quatro moles de ligações C–H quebradas por mole de reação. Embora as quatro ligações C–H sejam equivalentes na molécula original, cada uma delas não necessita da mesma energia para ser quebrada; uma vez que a primeira ligação é quebrada (o que requer 439 kJ/mol), as ligações restantes são mais fáceis de quebrar. O valor de 415 kJ/mol é a média, não o valor exacto necessário para quebrar cada ligação.
A força de uma ligação entre dois átomos aumenta à medida que o número de pares de eletrões na ligação aumenta. Geralmente, à medida que a força da ligação aumenta, o comprimento da ligação diminui. Assim, as ligações triplas são mais fortes e mais curtas que as ligações duplas entre os mesmos dois átomos; do mesmo modo, as ligações duplas são mais fortes e mais curtas que as ligações simples entre os mesmos dois átomos. Quando um átomo se liga a vários átomos em um grupo, a força de ligação normalmente diminui à medida que nos movemos para baixo no grupo. Por exemplo, para C–F é 439 kJ/mol, C–Cl é 330 kJ/mol, e C–Br é 275 kJ/mol.
As energias de ligação podem ser usadas para calcular as alterações da entalpia aproximadas para reações, também chamadas de entalpias de ligação, onde as entalpias de formação não estão disponíveis. Os cálculos deste tipo também indicam se uma reação é exotérmica ou endotérmica. Uma reação exotérmica (ΔH negativa, calor produzido) resulta quando as ligações nos produtos são mais fortes do que as ligações nos reagentes. Uma reação endotérmica (ΔH positiva, calor absorvido) resulta quando as ligações nos produtos são mais fracas do que as dos reagentes.
A alteração da entalpia, ΔH, para uma reação química é aproximadamente igual à soma da energia necessária para quebrar todas as ligações nos reagentes (energia que “entra”, sinal positivo) mais a energia libertada quando todas as ligações são formadas nos produtos (energia que “sai,”, sinal negativo). Isto pode ser expresso matematicamente da seguinte forma:

Nesta expressão, o símbolo Ʃ significa ““a soma de” e D representa a energia de ligação em kJ/mol, que é sempre um número positivo. A energia de ligação dependerá de se a ligação em particular é uma ligação simples, dupla, ou tripla. Assim, ao calcular as entalpias dessa forma, é importante que as ligações em todos os reagentes e produtos seja considerada. Como os valores de D são tipicamente médias para um tipo de ligação em muitas moléculas diferentes, este cálculo fornece uma estimativa aproximada, não um valor exacto, para a entalpia da reação.
Considere a seguinte reação:
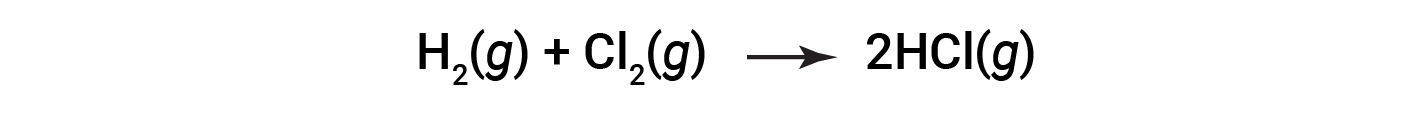
ou
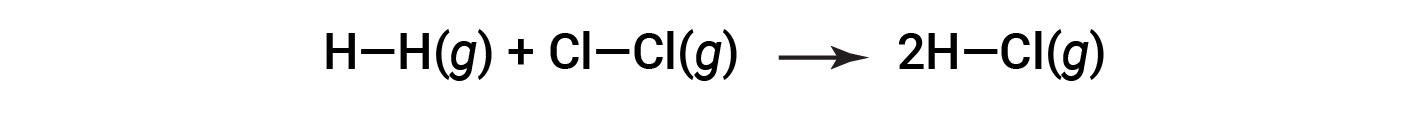
Para formar dois moles de HCl, um mole de ligações H–H e um mole de ligações Cl–Cl devem ser quebrados. A energia necessária para quebrar essas ligações é a soma da energia de ligação da ligação H–H (436 kJ/mol) e da ligação Cl–Cl (243 kJ/mol). Durante a reação, formam-se dois moles de ligações H–Cl (energia de ligação de 432 kJ/mol), libertando 2 × 432 kJ; ou 864 kJ. Como as ligações nos produtos são mais fortes do que as dos reagentes, a reação liberta mais energia do que consome:

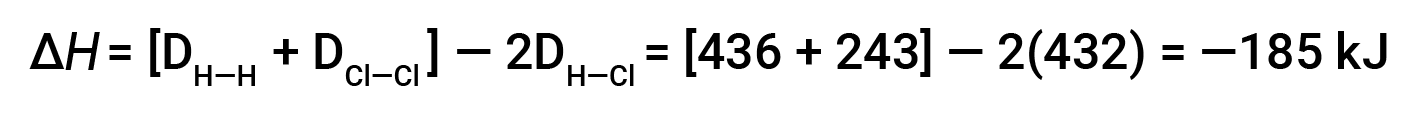
Esta energia em excesso é libertada como calor, pelo que a reação é exotérmica.
Este texto é adaptado de Openstax, Chemistry 2e, Section 7.5: Bond Strength: Covalent Bonds.
