6.11:
Entalpia de Formação Padrão
35,641 Views
•
•
As mudanças de entalpia são tipicamente tabuladas para reações nas quais tanto os reagentes como os produtos estão nas mesmas condições. Um estado padrão é um conjunto de condições comumente aceite, usado como ponto de referência para a determinação de propriedades sob outras condições diferentes. Para os químicos, o estado padrão IUPAC refere-se a materiais sob uma pressão de 1 bar e soluções a 1 M e não especifica uma temperatura. Muitas tabelas termoquímicas listam valores com um estado padrão de 1 atm. Como a ΔH de uma reação muda muito pouco com alterações tão pequenas na pressão (1 bar = 0,987 atm), os valores de ΔH (excepto os valores medidos com mais precisão) são essencialmente os mesmos em ambos os conjuntos de condições padrão. Um “o” em superscrito no símbolo de alteração da entalpia designa o estado padrão. Uma vez que a temperatura normal (mas não tecnicamente padrão) é de 298,15 K, esta temperatura será assumida a menos que seja especificada outra temperatura. Assim, o símbolo (ΔH°) é usado para indicar uma alteração da entalpia para um processo que ocorre nessas condições. (O símbolo ΔH é utilizado para indicar uma alteração de entalpia para uma reação que ocorre em condições não padrão.)
As alterações da entalpia para muitos tipos de processos químicos e físicos estão disponíveis na literatura de referência, inclusivamente para reações de combustão, transições de fase, e reações de formação. Uma vez que a alteração da entalpia para uma determinada reação é proporcional às quantidades de substâncias envolvidas, pode ser relatada com base nisso (isto é, como ΔH para quantidades específicas de reagentes). No entanto, nós consideramos muitas vezes que é mais útil dividir uma propriedade extensiva (ΔH) por outra (quantidade de substância), e relatar um valor intensivo de ΔH por quantidade, muitas vezes “normalizado” para uma base por mole.
Entalpia Padrão de Formação
A entalpia padrão de formação ΔHf° é uma alteração da entalpia para uma reação em que se forma exactamente 1 mole de uma substância pura a partir de elementos livres nos seus estados mais estáveis, em condições de estado normais. Estes valores são especialmente úteis para a computação ou previsão de alterações de entalpia para reações químicas impraticáveis ou perigosas, ou para processos para os quais é difícil realizar medições. Usando valores conhecidos de entalpia padrão de formação, a alteração da entalpia para qualquer reação pode ser determinada.
A entalpia padrão de formação de CO2 (g) é −393,5 kJ/mol. Esta é a alteração da entalpia para a reação exotérmica:
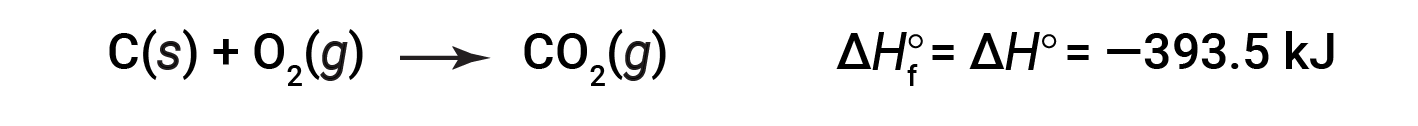
começando com os reagentes a uma pressão de 1 atm e 25 °C (com o carbono presente como grafite, a forma mais estável de carbono nestas condições) e terminando com um mole de CO2, também a 1 atm e 25 °C . Para o dióxido de azoto, NO2 (g), a ΔHf° é de 33,2 kJ/mol. Esta é a alteração da entalpia para a reação endotérmica:

Uma equação de reação com 1/2 moles de N2 e 1 mole de O2 está certa neste caso porque a entalpia padrão de formação refere-se sempre a 1 mole do produto: NO2 (g).
Por definição, a entalpia padrão de formação de um elemento na sua forma mais estável é igual a zero em condições normais. Por exemplo, as entalpias padrão de formação de carbono (grafeno), gás de oxigénio diatómico, gás de azoto diatómico, metal de sódio, e mercúrio líquido são zero em condições normais.
Este texto é adaptado de Openstax, Chemistry 2e, Section 5.3: Enthalpy.
