6.7:
열화학 반응식
6.7:
열화학 반응식
일정한 압력에서 수행된 화학 반응(system)의 경우 – 확장 또는 수축에 의한 유일한 작업- 반응의 엔탈피(반응의 열이라고도 함, ΔHrxn)는주변과 교환된 열과 동일하다(qp).
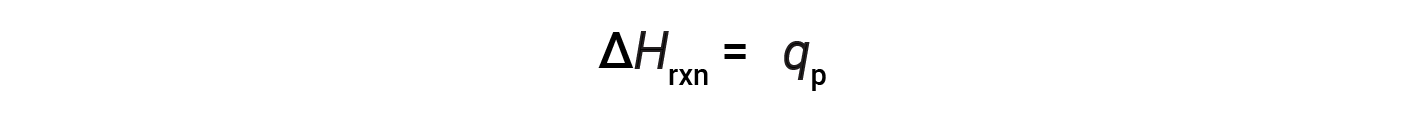
엔탈피의 변화는 광범위한 속성이며 반응 (또는 반응자의 두더지 수)에 참여하는 반응자의 양에 따라 달라집니다. 엔탈피의 변화는 반응에 국한되며, 반응및 제품 종의 물리적 상태가 중요하다. 외래 반응은 -ΔHrxn 값을 특징으로하며, 엔더믹 반응은 +ΔHrxn 값을가합니다.
반응에 의해 방출되거나 흡수되는 열의 양은 반응에 의해 소비되거나 생성된 각 물질의 양에 해당하기 때문에, 물질과 에너지 의 변화를 나타내기 위해 열화학 방정식을 사용하는 것이 편리하다. 열화학 방정식에서, 반응의 엔탈피의 변화는 ΔHrxn으로나타내며, 일반적으로 반응에 대한 방정식에 따라 제공된다. Δ Hrxn의 크기는 화학 방정식에 나타난 반응과 관련된 열의 양을 나타냅니다. Δ Hrxn의 징후는 반응이 서면으로 서술된 바와 같이 외형 또는 동체인지를 나타냅니다. 다음 방정식에서는 수소 가스 1두더지와 산소 가스 1/2 두더지(일부 온도 및 압력)가 액체 물 1두더지(동일한 온도 및 압력)를 형성하기 위해 반응합니다.
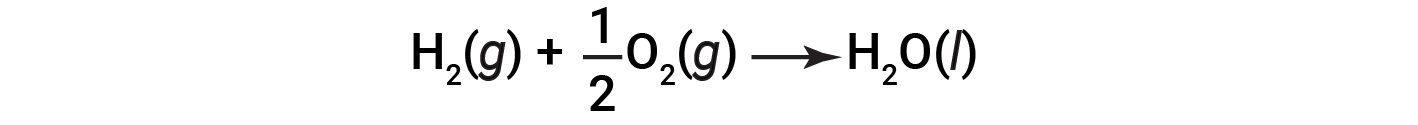
이 방정식은 286 kJ의 열이 주변 환경에 방출됨을 나타냅니다. 즉, 소비되는 수소의 모든 두더지 또는 생산되는 물의 모든 두더지에 대해 286 kJ의 열이 방출됩니다(반응은 외동적임). 따라서, 반응의 엔탈피는 반응의 특정 양을 포함하는 반응 중에 방출되거나 흡수되는 열의 양을 계산하는 데 사용될 수 있는 변환 계수이다.
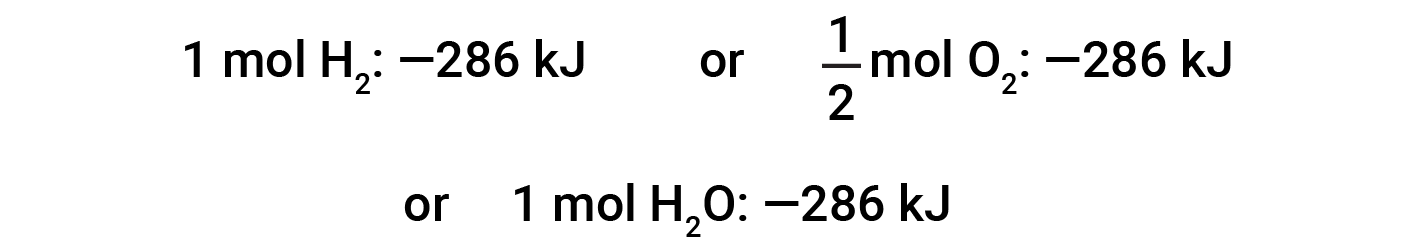
화학 방정식의 계수가 일부 요인(즉, 물질의 양이 변경되는 경우)을 곱하면 엔탈피의 변화가 동일한 인자를 곱해야 합니다.
(양2배 증가)
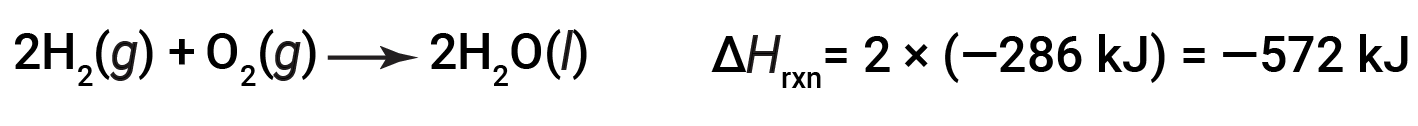
(금액의 2배 감소)
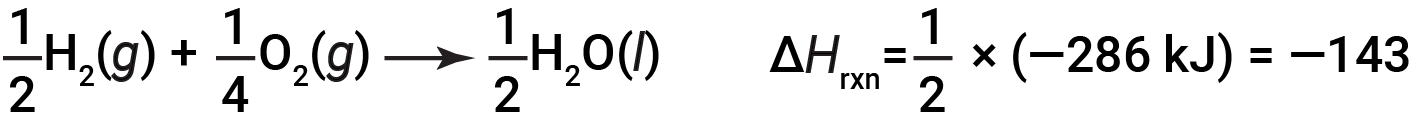
반응의 엔탈피 변화가 반응물질 및 제품의 물리적 상태에 달려 있음을 설명하기 위해 기체 수분 (또는 수증기)의 형성을 고려하십시오. 수소 가스 1두더기와 산소 가스 1/2 두더지가 기체수 1두더지가 형성되면 액체 물이 형성될 때 방출되는 286kJ의 열과는 달리 242kJ의 열만 방출됩니다.
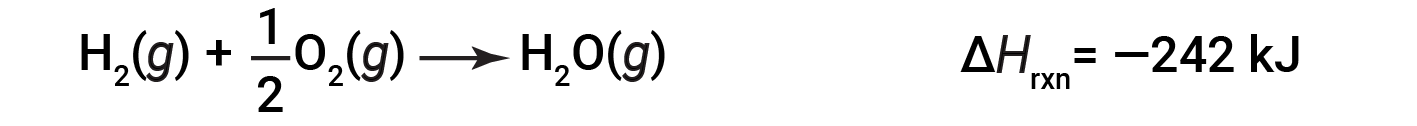
Leitura Sugerida
- Canagaratna, Sebastian G. "A visual aid in enthalpy calculations." Journal of Chemical Education 77, no. 9 (2000): 1178.
- Keifer, David. "Enthalpy and the Second Law of Thermodynamics." Journal of Chemical Education 96, no. 7 (2019): 1407-1411.
- Khalil, Mutasim I. "Calculating enthalpy of reaction by a matrix method." Journal of Chemical Education 77, no. 2 (2000): 185.
