4.12:
Кислоты, основания и реакции нейтрализации
50,608 Views
•
•
Кислотно-основная реакция — это реакция, при которой ион водорода, H+, переносится из одного химического вида в другой. Такие реакции имеют решающее значение для многочисленных природных и технологических процессов, начиная от химических преобразований в клетках или озерах и океанах до промышленного производства удобрений, фармацевтических препаратов и других веществ, необходимых для общества.
Существует несколько способов определения кислоты. В контексте водных растворов кислота является веществом, растворяющееся с получением ионов водорода.
Это определение Аррениуса кислоты, названное в честь шведского химика Сванте Аррениуса (1859–1927). Ион водорода, представленный символом H+, называется протоном. В раствор протоны химически объединяются с молекулами воды через неподелённые пары кислорода, образуя гидрониевые ионы, H3О+.
Химическое уравнение для ионизации кислоты записывается как
Кислоты, полностью реагируя водой таким образом, называются сильными кислотами. HCl, HNО3 и HBR являются несколькими примерами.
Большинство кислот, встречающихся в повседневной жизни, являются слабыми кислотами. В качестве примера можно привести лимонную кислоту во фруктах, уксусную кислоту в уксусе и молочную кислоту в молоке. Знакомым примером слабой кислоты является уксусная кислота, основной ингредиент пищевого уксуса. При растворении в воде в обычных условиях в ионизированной форме присутствует только около 1% молекул уксусной кислоты CH3CO2−.
Использование двойной стрелки в приведенном выше уравнении обозначает аспект частичной реакции этого процесса.
Основание – это вещество, растворяется в воде для получения ионов гидроксида, OH–. Наиболее распространенными основаниями являются ионные соединения, состоящие из щелочных или щелочных металлических катионов земли (группы 1 и 2) в сочетании с гидроксидным ионом, например, NaOH и Ca(OH)2. В отличие от ранее обсуждавшихся кислых соединений, эти соединения не вступают в химическую реакцию с водой; вместо этого они растворяются и диссоциируют, высвобождая ионы гидроксида непосредственно в раствор. Например, KOH и Ba(OH)2 растворяются в воде и полностью диссоциируются для производства катионов (K+ и Ba2+ соответственно) и ионов гидроксида, OH–. Эти основания, наряду с другими гидроксидами, полностью диссоциирующими в воде, считаются сильными основаниями.
Рассмотрим растворение гидроксида натрия в воде в качестве примера:
Это уравнение подтверждает, что гидроксид натрия является основанием. При растворении в воде NaOH диссоциирует для получения ионов Na+ и OH. Это также относится к любому другому ионному соединению, содержащему ионы гидроксида. Поскольку процесс диссоциации в основном завершен, когда ионные соединения растворяются в воде в типичных условиях, NaOH и другие ионные гидроксиды классифицируются как сильные основания.
В отличие от ионных гидроксидов, некоторые соединения производят ионы гидроксида при растворении химически реагируя с молекулами воды. Во всех случаях эти соединения реагируют только частично, и классифицируются как слабые основания. Эти типы соединений также изобилуют по своей природе и являются важными товарами в различных технологиях. Например, глобальное производство слабого базового аммиака, как правило, значительно превышает 100 метрических тонн в год, поскольку он широко используется в качестве сельскохозяйственных удобрений, сырья для химического синтеза других соединений и активного ингредиента бытовых чистящих средств. При растворении в воде аммиак частично реагирует на ионы гидроксида, как показано ниже:
Это, по определению,кислотно-основная реакция, включающая перенос ионов H+ из молекул воды в молекулы аммиака. В типичных условиях в виде ионов NH4+ присутствует только около 1% растворенного аммиака.
Реакция нейтрализации — это специфический тип кислотно-основной реакции, в которой реагентами являются кислота и основание (но не вода), а продукты – соль и вода:

Чтобы проиллюстрировать реакцию на нейтрализацию, подумайте, что происходит, когда типичный антацид, например, молоко магнезии (водная суспензия цельного Mg(OH)2) проглатывается, чтобы облегчить симптомы, связанные с избытком желудочной кислоты (HCl):

Обратите внимание, что в дополнение к воде в результате этой реакции образуется соль, хлорид магния. H+ (aq) из кислоты (сильной или слабой) соединяется с OH– (aq) из основания (или вырабатывается в результате реакции слабого основание с водой) с образованием H2O (l). Например, реакция водных растворов HCl (сильной кислоты) и NaOH (сильной основание) написана следующим образом:

И HCl, и NaOH подвергаются 100% ионизации. Таким образом, полное ионное уравнение может быть записано как:
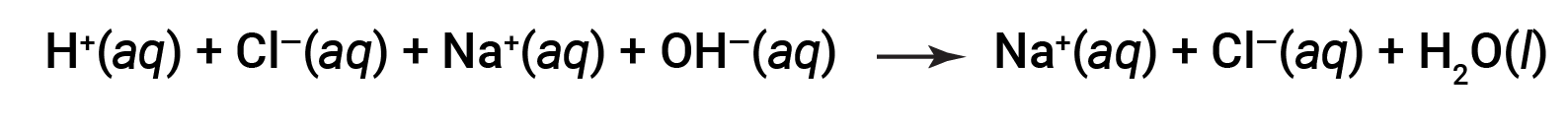
CL– и Na+ называются ионы-наблюдатели, которые компенсируются, давая чистое ионное уравнение как: & nbsp;
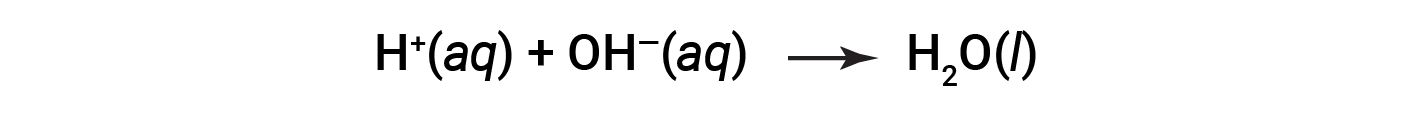
Этот текст был адаптирован из OpenStax Химия 2е изд., раздел 4.2: Классификация химических реакций.
