4.2:
한계반응물
49,146 Views
•
•
균형 잡힌 화학 방정식에 표현된 반응제 및 제품의 상대적인 양은 종종 stoichiometric양이라고합니다. 그러나 실제로, 반응제가 항상 균형 잡힌 방정식으로 표시된 금식양에 존재하는 것은 아니다.
화학 반응에서, 먼저 소비되는 반응제는 형성된 제품의 양을 제한하고, 제한 반응제이며, 다른 물질은 과잉 반응제가 된다. 하나 이상의 반응물질을 초과하는 것은 종종 다른 반응제를 제품으로 완전히 변환하는 데 사용됩니다.
방정식으로 표시되는 물의 형성에 대한 반응을 고려하십시오.
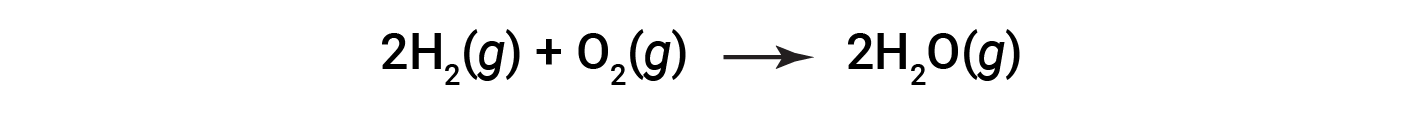
균형 잡힌 방정식은 수소와 산소가 2:1 stoichiometric 비율로 반응하는 것을 보여줍니다. 이러한 반응제가 다른 양으로 제공되는 경우, 반응제 중 하나가 거의 항상 완전히 소모되므로 생성될 수 있는 제품의 양이 제한됩니다. 이 물질은 제한 반응제이며, 다른 물질은 과잉 반응제이다. 주어진 상황에 대한 제한 및 초과 반응제를 식별하려면 제공된 각 반응제의 어금량을 계산하고 균형 잡힌 화학 방정식에 표시되는 금식량과 비교해야 합니다.
Stoichiometry는 수소의 두더지와 산소의 한 두더지가 물의 두 두 더지를 생성하기 위하여 반응한다는 것을 표시합니다; 즉, 수소와 산소는 2:1 비율로 결합됩니다. 수소 5두더지와 2개의 두더지가 존재하는지 상상해 보십시오. 반응제의 비율은 이제 5:2 (또는 2.5:1)이며, 이는 2:1의 stoichiometric 비율보다 큽니다. 따라서 수소는 과잉으로 존재하며 산소는 제한 반응제이다. 제공된 모든 산소(2 mol)의 반응은 제공된 수소 5mol의 4 mol을 소비하여 1 mol의 수소가 반응하지 않습니다. 제공된 각 반응제의 어금량을 계산하고 균형 잡힌 화학 방정식에 표시되는 금식형 양과 비교하는 것은 제한 및 과잉 반응제를 식별하는 한 가지 방법입니다.
다른 접근법은 반응의 stoichiometry에 따라 각 반응제에서 두더지에서 형성된 제품의 양을 계산한 다음 양을 비교하는 것을 포함합니다. 제품 두더지의 적은 양을 생산하는 반응은 제한 반응입니다. 예를 들어, 수소 의 다섯 두더지의 완전한 반응은 얻을 것이다 :

마찬가지로, 산소의 두더지 두 더지의 완전한 반응은 얻을 것이다 :

산소는 물의 두더지 적은 생성, 따라서, 산소는 제한 반응이다. 산소는 H2O의 4 두더지가 생성되면 완전히 소모됩니다. 수소와 산소 사이의 금식측정은 2:1이며, 수소의 네 두더지는 산소의 두 더스와 반응하기 위해 필요합니다.

따라서,(5 mol H2 – 4 mol H2 = 1 mol H2),이 반응이 완료되면 반응하지 않은 수소의 한 두더지가 유지됩니다.
