2.5:
A Tabela Periódica
62,329 Views
•
•
Com a descoberta de mais elementos pelos primeiros químicos, eles aperceberam-se que vários elementos poderiam ser agrupados pelos seus comportamentos químicos semelhantes. Um desses grupos inclui lítio (Li), sódio (Na), e potássio (K). Todos estes elementos são brilhantes, conduzem bem o calor e a eletricidade, e têm propriedades químicas semelhantes. Um segundo grupo inclui cálcio (Ca), estrôncio (Sr), e bário (Ba), que também são brilhantes, bons condutores de calor e eletricidade, e têm propriedades químicas em comum. No entanto, as propriedades específicas destes dois grupos são notavelmente diferentes um do outro. Por exemplo, Li, Na, e K são muito mais reativos do que Ca, Sr, e Ba. Além disso, Li, Na, e K formam compostos com oxigénio em uma proporção de dois dos seus átomos para um átomo de oxigénio, enquanto que Ca, Sr, e Ba formam compostos de um dos seus átomos para um átomo de oxigénio. O flúor (F), o cloro (Cl), o bromo (Br), e o iodo (I) também apresentam propriedades semelhantes entre si, mas estas propriedades são drasticamente diferentes das de qualquer um dos elementos acima.
Dimitri Mendeleev na Rússia (1869) e Lothar Meyer na Alemanha (1870) reconheceram, de forma independente, uma relação periódica entre as propriedades dos elementos conhecidos na época. Ambos publicaram tabelas com os elementos dispostos de acordo com o aumento da massa atómica. No entanto, Mendeleev foi um passo mais longe do que Meyer; ele usou a sua tabela para prever a existência de elementos que teriam propriedades semelhantes ao alumínio e ao silício mas que ainda não eram conhecidos. As descobertas do gálio (1875) e do germânio (1886) forneceram um apoio significativo ao trabalho de Mendeleev. Embora Mendeleev e Meyer tenham tido uma longa disputa sobre a prioridade, as contribuições de Mendeleev para o desenvolvimento da tabela periódica são agora mais amplamente reconhecidas.
Por altura do século XX, tornou-se evidente que a relação periódica envolvia números atómicos em vez de massas atómicas. A declaração moderna dessa relação, a lei periódica, afirma o seguinte: As propriedades dos elementos são funções periódicas dos seus números atómicos. Uma tabela periódica moderna organiza os elementos por ordem crescente dos seus números atómicos, e agrupa átomos com propriedades semelhantes na mesma coluna vertical. Cada caixa representa um elemento e contém o seu número atómico, símbolo, massa atómica média e (às vezes) nome.
Os elementos estão dispostos em sete linhas horizontais, chamadas de períodos ou séries, e 18 colunas verticais, chamadas de grupos. Os grupos são identificados no topo de cada coluna. Para que a tabela caiba em uma única página, partes de duas das linhas, um total de 14 colunas, são geralmente escritas abaixo do corpo principal da tabela.
Muitos elementos diferem significativamente nas suas propriedades químicas e físicas, mas alguns elementos são semelhantes nos seus comportamentos. Por exemplo, muitos elementos parecem brilhantes, são maleáveis e dúcteis, e conduzem bem o calor e a eletricidade. Outros elementos não são brilhantes, maleáveis ou dúcteis, e são condutores pobres de calor e eletricidade. Os elementos podem ser classificados em classes grandes com propriedades comuns: metais (elementos brilhantes, maleáveis, bons condutores de calor e eletricidade — sombreados a amarelo); não metais (elementos que parecem baços, condutores pobres de calor e eletricidade — sombreados a vermelho); e metalóides (elementos que conduzem o calor e a eletricidade moderadamente bem, e possuem algumas propriedades de metais e algumas propriedades de não metais — sombreados a roxo).
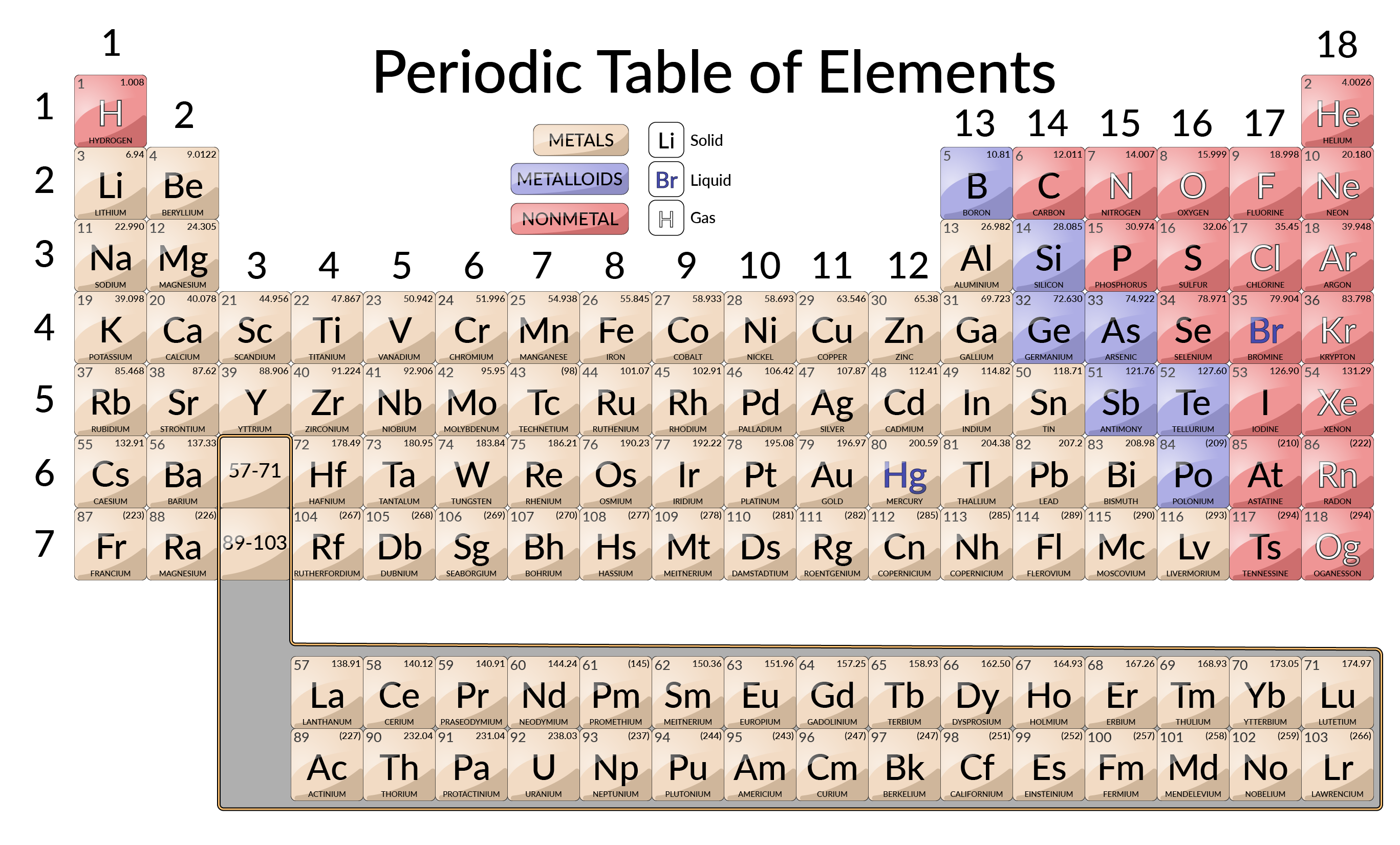
Os elementos também podem ser classificados em elementos do grupo principal (ou elementos representativos) nas colunas identificadas como 1, 2 e 13–18; os metais de transição nas colunas identificadas como 3–12; e os metais de transição internos nas duas linhas no fundo da tabela. Os elementos da linha superior do fundo da tabela são lantanídeos, e os elementos da linha inferior são actinídeos. Os elementos podem ser subdivididos por propriedades mais específicas, tais como a composição dos compostos que formam. Por exemplo, os elementos do grupo 1 (primeira coluna) formam compostos que consistem em um átomo do elemento e um átomo de hidrogénio. Estes elementos (excepto o hidrogénio) são conhecidos como metais alcalinos e têm todos propriedades químicas semelhantes. Os elementos do grupo 2 (segunda coluna) formam compostos constituídos por um átomo do elemento e dois átomos de hidrogénio: Estes são denominados metais alcalinoterrosos, com propriedades semelhantes entre os membros desse grupo.
Outros grupos com nomes específicos são os pnictogénios (grupo 15), os calcogénios (grupo 16), os halogénios (grupo 17), e os gases nobres (grupo 18, também conhecidos como gases inertes). Os grupos também podem ser referidos pelo primeiro elemento do grupo: Por exemplo, os calcogénios podem ser chamados de grupo do oxigénio ou família do oxigénio. O hidrogénio é um elemento único e não metálico com propriedades semelhantes aos elementos do grupo 1 e do grupo 17. Por essa razão, o hidrogénio pode ser apresentado no topo de ambos os grupos, ou por si só.
O elemento 43 (tecnécio), o elemento 61 (prometério), e a maioria dos elementos com número atómico 84 (polónio) e superior têm a sua massa atómica entre parênteses rectos. Isto é feito para elementos que consistem inteiramente de isótopos radioativos instáveis (a radioatividade é coberta em mais detalhes no capítulo da química nuclear). Um peso atómico médio não pode ser determinado para estes elementos porque os seus radioisótopos podem variar significativamente em abundância relativa, dependendo da fonte, ou podem mesmo não existir na natureza. O número entre parênteses rectos é o número de massa atómica, que é uma massa atómica aproximada do isótopo mais estável desse elemento.
Texto adaptado de Openstax, Chemistry 2e, Section 2.5: The Periodic Table.
