16.5:
Efficacia del buffer
43,805 Views
•
•
Le soluzioni buffer non hanno una capacità illimitata di mantenere il pH relativamente costante . Invece, la capacità di una soluzione tampone di resistere ai cambiamenti nel pH si basa sulla presenza di quantità apprezzabili della sua coppia acido-base debole coniugata. Quando viene aggiunto abbastanza acido o base forte per abbassare sostanzialmente la concentrazione di uno dei membri della coppia tampone, l’azione di buffering all’interno della soluzione viene compromessa.
La capacità tampone è la quantità di acido o base che può essere aggiunta a un dato volume di una soluzione tampone prima che il pH cambi in modo significativo, di solito di un’unità. La capacità tampone dipende dalle quantità dell’acido debole e dalla sua base coniugata che si trovano in una miscela tampone. Ad esempio, 1 L di una soluzione che è 1,0 M in acido acetico e 1,0 M in acetato di sodio ha una capacità tampone maggiore di 1 L di una soluzione che è 0,10 M in acido acetico e 0,10 M in acetato di sodio anche se entrambe le soluzioni hanno lo stesso pH. La prima soluzione ha più capacità tampone perché contiene più acido acetico e ione acetato.
Selezione di miscele tampone adatte
Esistono due utili regole empiriche per la selezione delle miscele tampone:
- Una buona miscela tampone dovrebbe avere concentrazioni circa uguali di entrambi i suoi componenti. Una soluzione buffer ha generalmente perso la sua utilità quando un componente della coppia buffer è inferiore a circa il 10% dell’altro.
- Gli acidi deboli e i loro sali sono migliori come tamponi per i pHs inferiori a 7; le basi deboli e i loro sali sono migliori come cuscinetti per i pH superiori a 7.
Il sangue è un esempio importante di soluzione tamponata, con l’acido principale e lo ione responsabili dell’azione tamponamento che è acido carbonico, H2CO3e lo ione bicarbonato, HCO3−. Quando uno ione idronio viene introdotto nel flusso sanguigno, viene rimosso principalmente dalla reazione:
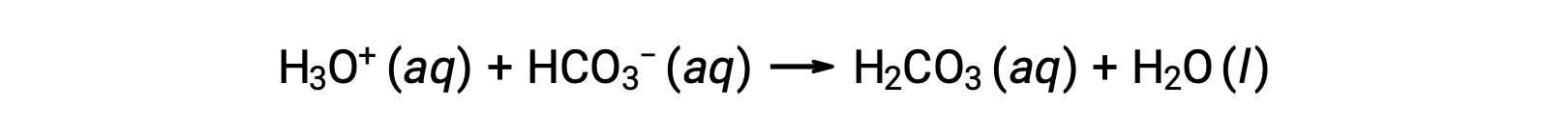
Un ulteriore ione idrossido viene rimosso dalla reazione:
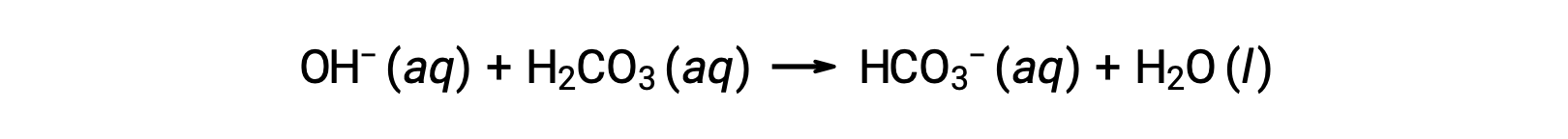
L’acido o la base forte aggiunto viene quindi effettivamente convertito nell’acido o nella base molto più debole della coppia tampone (H3O+ viene convertito in H2CO3 e OH− viene convertito in HCO3−). Il pH del sangue umano rimane quindi molto vicino al valore determinato dalle coppie tampone pKa, in questo caso, 7.35. Le normali variazioni nel pH nel sangue sono generalmente inferiori a 0,1 e i cambiamenti di pH di 0,4 o superiori sono probabilmente fatali.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.6: Buffers.
