15.12:
Ácidos Polipróticos
24,764 Views
•
•
Los ácidos se clasifican por el número de protones por molécula que pueden ceder en una reacción. Los ácidos como HCl, HNO3 y HCN que contienen un átomo de hidrógeno ionizable en cada molécula se denominan ácidos monopróticos. Sus reacciones con el agua son:
| Ácidos monoproticos: Reacciones con el agua |
| HCl (ac) + H2O (l) ⟶ H3O+ (ac) + Cl− (ac) |
| HNO3 (ac) + H2O (l) ⟶ H3O+ (ac) + NO3− (ac) |
| HCN (ac) + H2O (l) ⇌ H3O+ (ac) + CN− (ac) |
Aunque contiene cuatro átomos de hidrógeno, el ácido acético, CH3CO2H, también es monoprótico porque sólo el átomo de hidrógeno del grupo carboxilo (COOH) reacciona con las bases:
De manera similar, las bases monopróticas son bases que aceptarán un solo protón.
Los ácidos dipróticos contienen dos átomos de hidrógeno ionizables por molécula; la ionización de dichos ácidos ocurre en dos pasos. La primera ionización siempre tiene lugar en mayor medida que la segunda ionización. Por ejemplo, el ácido sulfúrico, un ácido fuerte, se ioniza de la siguiente manera:
| Ácido diprotico: Ácido sulfúrico (H2SO>4) | ||
| 1eraionización | H2SO4 (ac) + H2O (l) ⇌ H3O+ (ac) + HSO4− (ac) | Ka1 = Más de 102; disociación completa |
| 2daionización | HSO4− (ac) + H2O (l) ⇌ H3O+ (ac) + SO42− (ac) | Ka2 = 1,2 × 10−2 |
Este proceso de ionización escalonado ocurre para todos los ácidos polipróticos. El ácido carbónico, H2CO3, es un ejemplo de un ácido diprotico débil. La primera ionización del ácido carbónico produce iones hidronio e iones bicarbonato en pequeñas cantidades.
Primera ionización: H2CO3 (ac) + H2O (l) ⇌ H3O+ (ac) + HCO3− (ac)
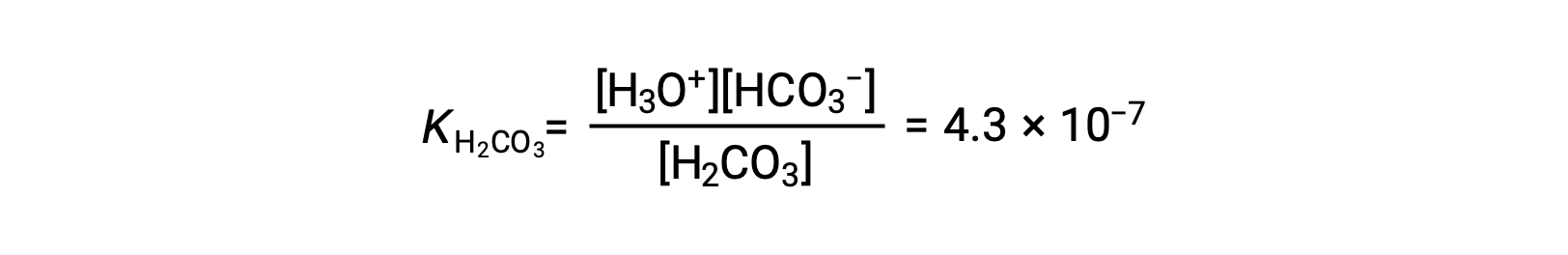
El ion bicarbonato también puede actuar como un ácido. Ioniza y forma iones hidronio e iones carbonato en cantidades aún más pequeñas.
Segunda ionización: HCO3− (ac) + H2O (l) ⇌ H3O+ (ac) + CO32− (ac)

KH2CO3 es mayor que KHCO3− por un factor de 104, por lo que H2CO3 es el productor dominante de iones de hidronio en la solución. Esto significa que poco de los HCO3− formados por la ionización de H2CO3 ioniza para dar iones hidronio (e iones carbonato), y las concentraciones de H3O+ y HCO3− son prácticamente iguales en una solución acuosa pura de H2CO3.
Si la primera constante de ionización de un ácido diprótico débil es mayor que la segunda por un factor de al menos 20, es apropiado tratar la primera ionización por separado y calcular las concentraciones resultantes de ella antes de calcular la concentración de especies resultantes de la ionización subsecuente. Este enfoque se demuestra en el siguiente ejercicio de ejemplo.
Ionización de un ácido diprótico
El “agua carbonatada” contiene una cantidad aceptable de dióxido de carbono disuelto. La solución es ácida porque el CO2 reacciona con el agua para formar ácido carbónico, H2CO3. ¿Cuáles son las [H3O+], [HCO3−] y [CO32− en una solución saturada de CO2 con un [H2CO3] inicial = 0,033?
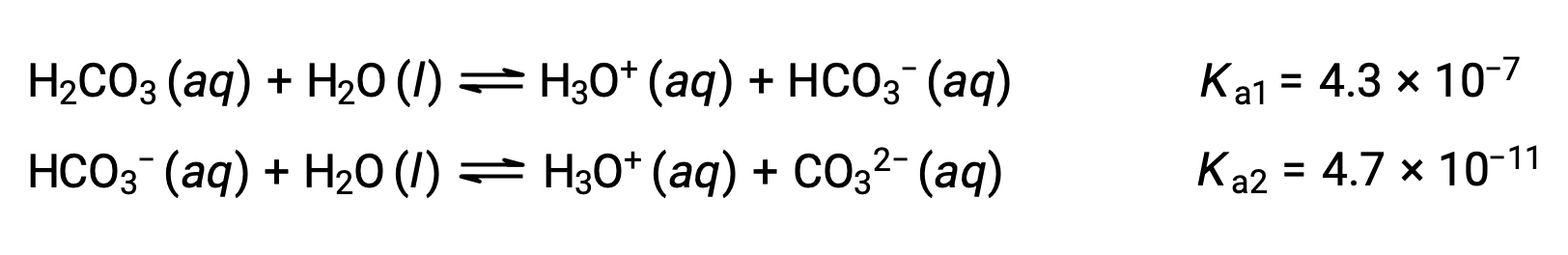
Como indican las constantes de ionización, H2CO3 es un ácido mucho más fuerte que HCO3−, por lo que las reacciones de ionización escalonada pueden tratarse por separado. Utilizando la información proporcionada, se prepara una tabla ICE para este primer paso de ionización:
| H2CO3(ac) | H3O+(ac) | HCO3−(ac) | |
| Concentración inicial (M) | 0,033 | ~0 | 0 |
| Cambio (M) | −x | +x | +x |
| Concentración de equilibrio (M) | 0,033 − x | x | x |
Al sustituir las concentraciones de equilibrio en la ecuación de equilibrio queda
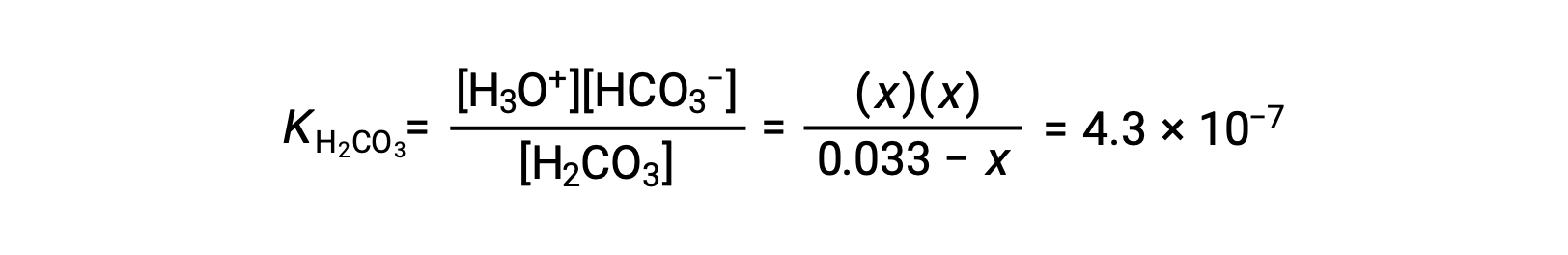
Si se asume que x << 0,033 y se resuelve la ecuación simplificada, se obtiene
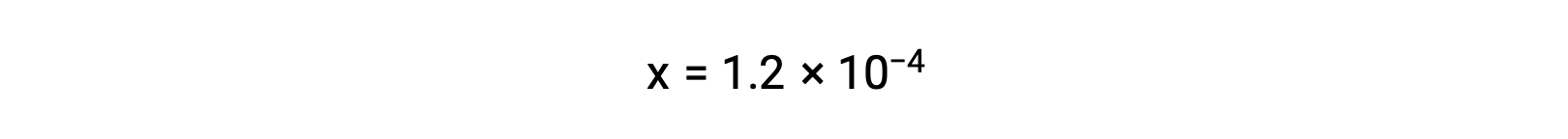
La tabla ICE define x como igual a la molaridad de los iones bicarbonato y a la molaridad de los iones hidronio:
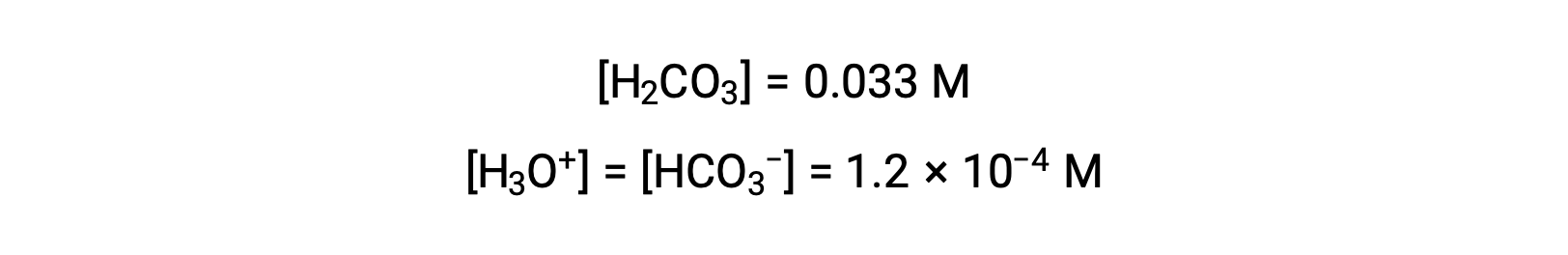
Utilizando la concentración de iones bicarbonato calculada anteriormente, la segunda ionización es sometida a un cálculo de equilibrio similar: HCO3− (ac) + H2O (l) ⇌ H3O+ (ac) + CO32−(ac)
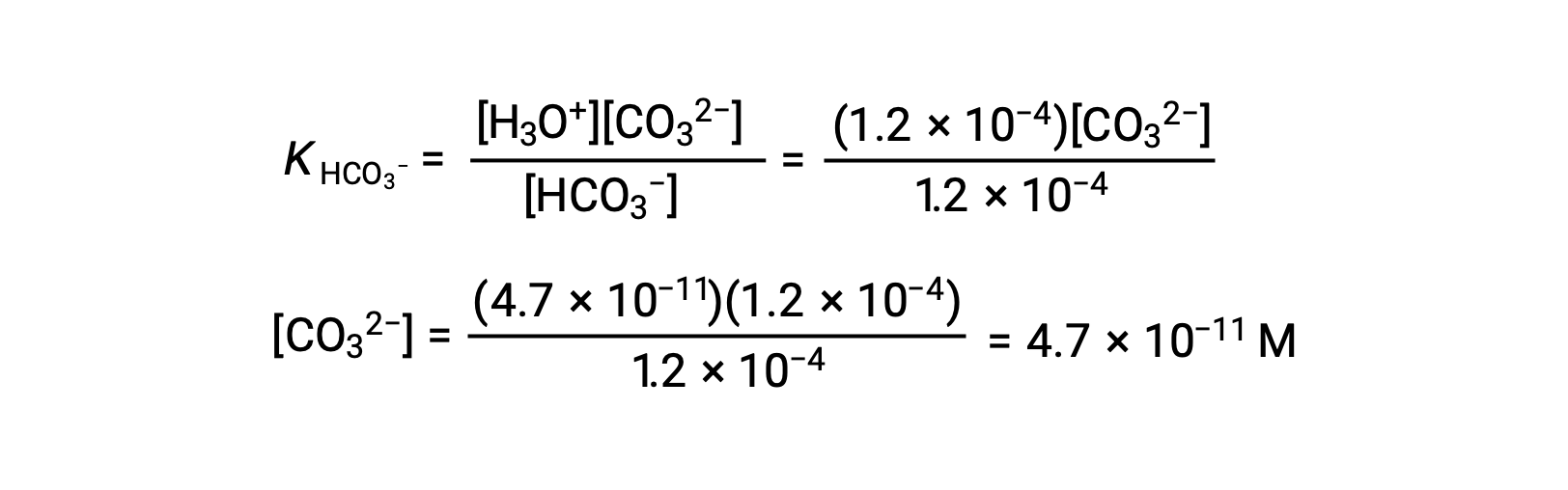
En resumen: En equilibrio [H2CO3] = 0,033 M; [H3O+] = 1,2 × 10−4; [HCO3−] = 1,2 × 10−4 M; y [CO32−] = 4,7 × 10−11 M.
Un ácido triprótico es un ácido que tiene tres átomos de H ionizables. El ácido fosfórico es un ejemplo:
| Ácido triprótico: Ácido fosfórico (H3PO4) | ||
| 1era ionización | H3PO4(ac) + H2O (l) ⇌ H3O+ (ac) + H2PO4− (ac) | Ka1 = 7,5 × 10−3 |
| 2da ionización | H2PO4− (ac) + H2O (l) ⇌ H3O+ (ac) + HPO42− (ac) | Ka2 = 6,2 × 10−8 |
| 3era ionización | HPO42− (ac) + H2O (l) ⇌ H3O+ (ac) + PO43− (ac) | Ka3 = 4,2 × 10−13 |
En cuanto a los ejemplos de ácido diprótico, cada reacción de ionización sucesiva es menos extensa que la primera, reflejada en valores decrecientes para las constantes de ionización ácida escalonadas. Esta es una característica general de los ácidos polipróticos y las constantes de ionización sucesivas a menudo difieren en un factor de aproximadamente 105 a 106.
Este conjunto de tres reacciones de disociación puede dar la impresión de complicar el cálculo de las concentraciones de equilibrio en una solución de H3PO4. Sin embargo, debido a que las constantes de ionización sucesivas difieren en un factor de 105 a 106, existen grandes diferencias en los pequeños cambios de concentración que acompañan a las reacciones de ionización. Esto permite el uso de supuestos y procesos de simplificación matemática, como se demostró en los ejemplos anteriores. Las bases polipróticas son capaces de aceptar más de un ion hidrógeno. El ión carbonato es un ejemplo de base diprótica, ya que puede aceptar dos protones, como se muestra a continuación. Al igual que en el caso de los ácidos polipróticos, observe que las constantes de ionización disminuyen con el paso de ionización. De la misma manera, los cálculos de equilibrio que implican bases polipróticas siguen los mismos enfoques que los de los ácidos polipróticos.
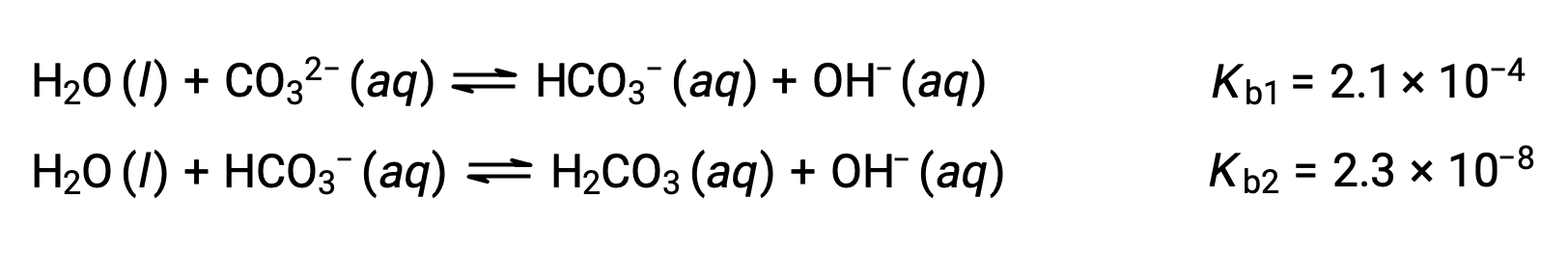
Este texto es adaptado de Openstax, Química 2e, Sección 14.5: Ácidos Polipróticos.
