15.8:
Solutions de base faible
19,658 Views
•
•
Certains composés produisent des ions hydroxyde lorsqu’ils sont dissous par réaction chimique avec des molécules d’eau. Dans tous les cas, ces composés ne réagissent que partiellement et sont donc classés comme des bases faibles. Ces types de composés sont également abondants dans la nature et ce sont d’importants produits de base dans diverses technologies. Par exemple, la production mondiale de la base faible ammoniac dépasse généralement 100 tonnes métriques par an, étant largement utilisée comme engrais agricole, matière première pour la synthèse chimique d’autres composés et ingrédient actif dans les nettoyants ménagers. Lorsqu’il est dissout dans l’eau, l’ammoniac réagit partiellement pour produire des ions d’hydroxyde, comme illustré ci-dessous :
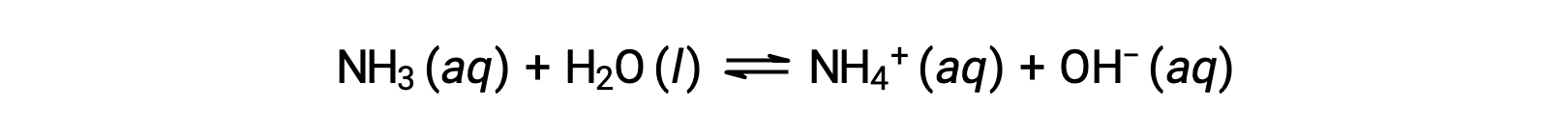
Il s’agit, par définition, d’une réaction acido-basique, dans ce cas impliquant le transfert d’ions H+ des molécules d’eau vers les molécules d’ammoniac. Dans des conditions normales, seulement environ 1 % de l’ammoniac dissous est présent sous forme d’ions NH4+.
Calcul des concentrations en ions d’hydroxyde et du pOH dans une solution de base faible
Trouvez la concentration de l’ion hydroxyde, le pOH, et le pH d’une solution de 0,25 M de triméthylamine, une base faible :
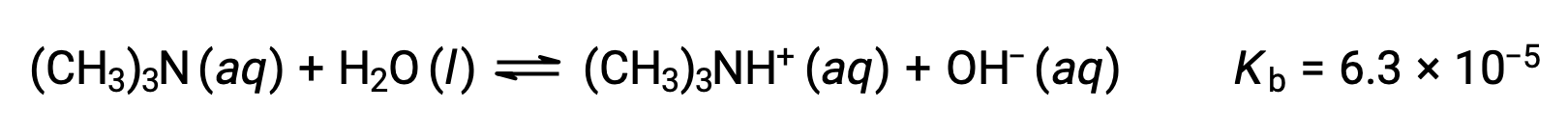
Le tableau ICE de ce système est
| (CH3)3N (aq) | (CH3)3NH+ (aq) | OH− (aq) | |
| Concentration initiale (M) | 0,25 | 0 | ~0 |
| Changement (M) | −x | +x | +x |
| Concentration à l’équilibre (M) | 0,25 − x | 0 + x | ~0 + x |
La substitution des termes de la concentration à l’équilibre dans l’expression de Kb donne
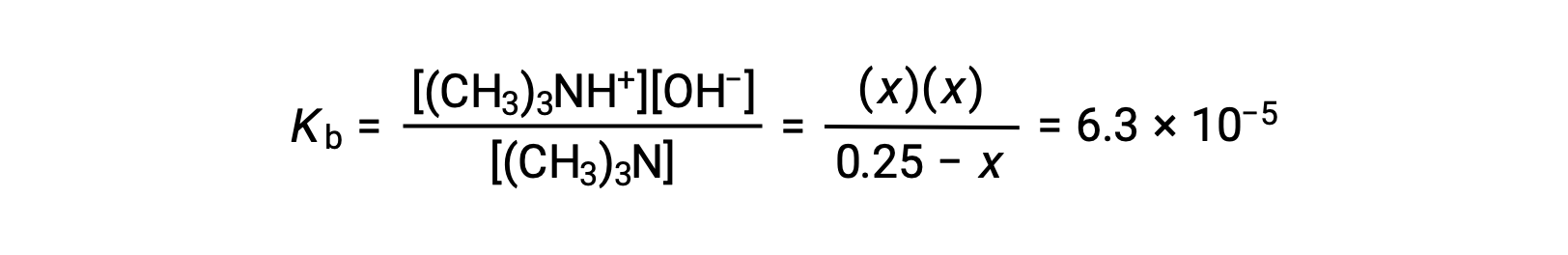
En supposant que x << 0,25 et en résolvant x, cela donne
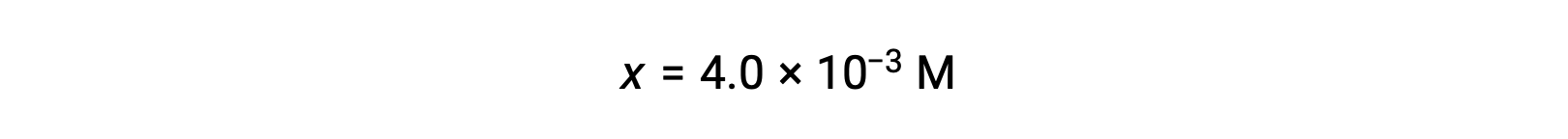
Cette valeur est inférieure à 5 % de la concentration initiale (0,25), de sorte que la supposition est justifiée.
Comme défini dans le tableau ICE, x est égal à la concentration à l’équilibre de l’ion hydroxyde :
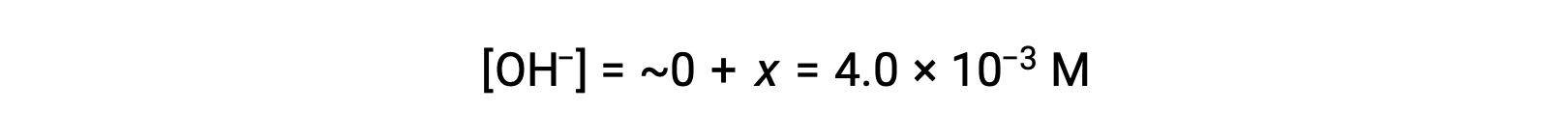
Le pOH est calculé comme étant
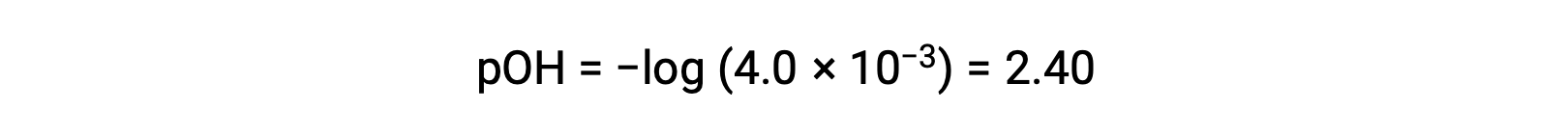
En utilisant la relation ;
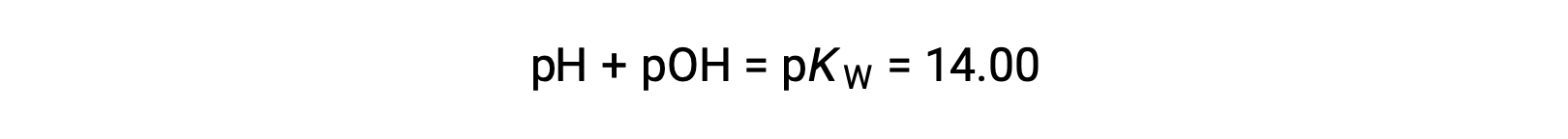
Permet le calcul du pH :
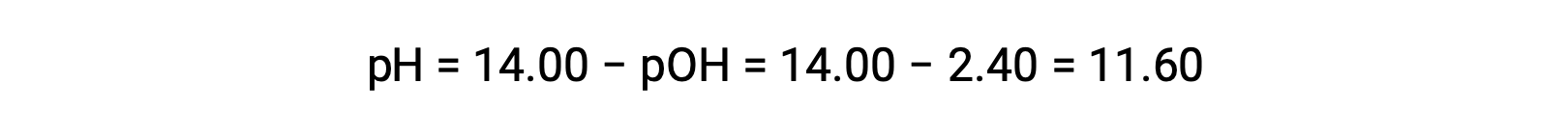
Détermination de Kb à partir du pH
Le pH d’une solution 0,28 M d’éthylamine (C2H5NH2) est de 12,10 ; quel est son Kb ?
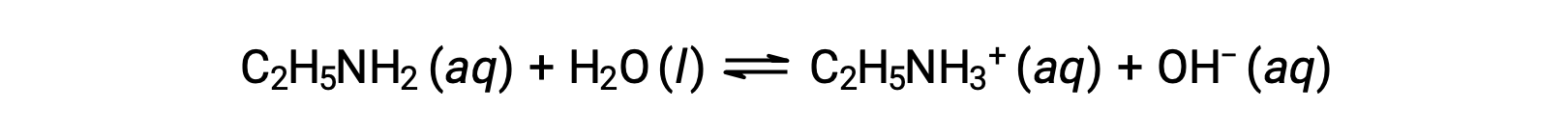
Pour calculer le Kb de l’éthylamine, il faut d’abord déterminer le pOH et la concentration en ions hydroxyde. Le pH est de 12,10 et donc le pOH peut être calculé comme suit :
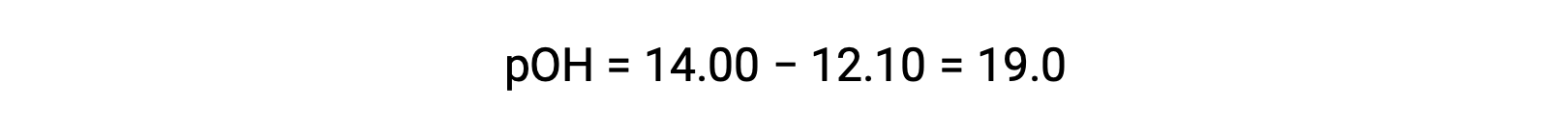
Le pOH est de 1,90 et donc la concentration en ions hydroxyde de la solution peut être calculée à l’aide de la formule
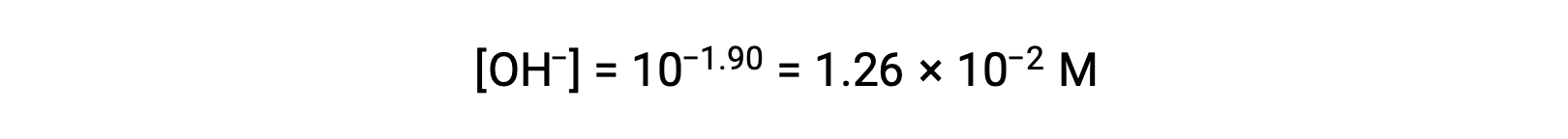
Le tableau ICE peut être construit pour ce système comme suit
| C2H5NH2 (aq) | C2H5NH3+ (aq) | OH− (aq) | |
| Concentration initiale (M) | 0,28 | 0 | ~0 |
| Changement (M) | −0,0126 | +0,0126 | +0,0126 |
| Concentration à l’équilibre (M) | 0,28 − 0,0126 | 0,0126 | 0,0126 |
0,0126 M représente 4,5 % de 0,28 M et on peut donc considérer 0,28 − 0,0126 comme presque égal à 0,28 M grâce à la règle des 5 %.
Après avoir remplacé les valeurs ci-dessus dans l’expression du Kb de l’éthylamine,
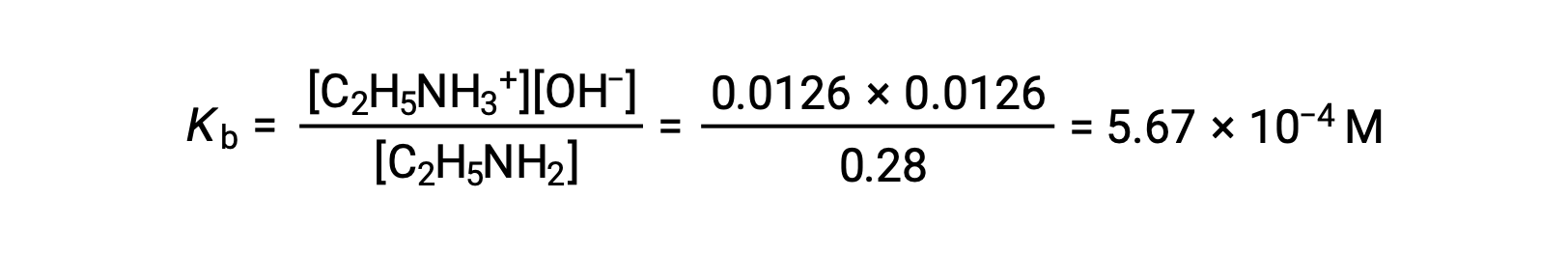
Ce texte est adapté de Openstax, Chimie 2e Section 4.2 : Classifier les réactions chimiques et 14.3 Forces relatives des acides et des bases.
