14.8:
Principe de Le Châtelier : modification du volume (pression)
29,636 Views
•
•
Pour les équilibres en phase gazeuse, des changements de la concentration des réactifs et des produits peuvent se produire lorsque le volume et la pression sont modifiés. La pression partielle, P, d’un gaz parfait est proportionnelle à sa concentration molaire, M.
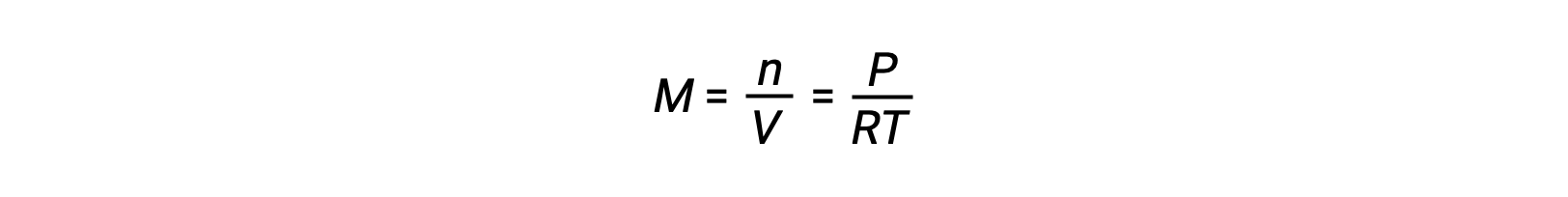
Ainsi, les modifications des pressions partielles d’un réactif ou d’un produit sont essentiellement des changements de concentrations ; par conséquent, ces modifications produisent les mêmes effets sur les équilibres. Outre l’ajout ou l’élimination de réactifs ou de produits, les pressions (concentrations) des espèces dans un équilibre en phase gazeuse peuvent également être modifiées en modifiant le volume occupé par le système. Étant donné que toutes les espèces d’un équilibre en phase gazeuse occupent le même volume, une modification donnée du volume entraînera le même changement de concentration pour les réactifs et les produits. Afin de discerner quel déplacement, le cas échéant, ce type de contrainte induit, la stœchiométrie de la réaction doit être considérée.
À l’équilibre, la réaction N2 (g) + O2 (g) ⇌ 2 NO (g) est décrite par le quotient de la réaction
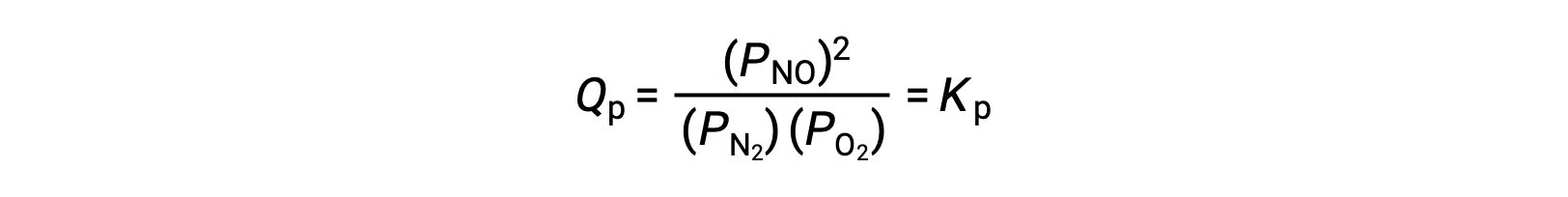
Si on diminue par un facteur de 3 le volume occupé par un mélange en équilibre de ces espèces, les pressions partielles des trois espèces seront augmentées par un facteur de 3 :
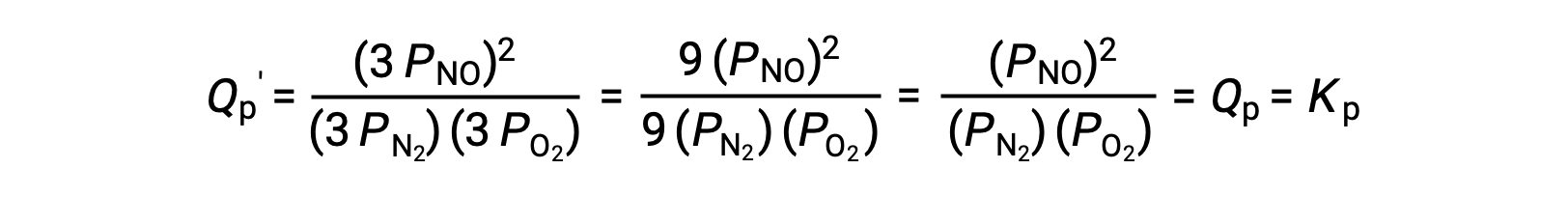
Ainsi, la modification du volume de ce mélange en équilibre en phase gazeuse n’entraîne pas un déplacement de l’équilibre.
En traitant de façon similaire un système différent, 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g), cela donne toutefois un résultat différent :
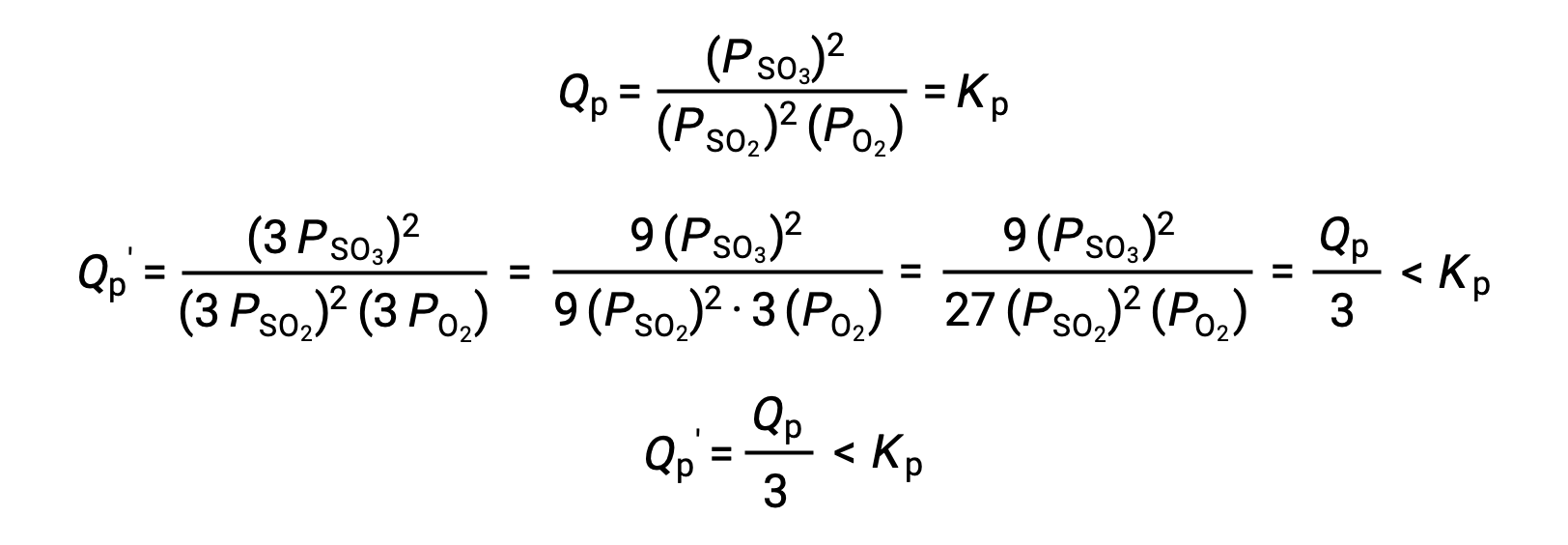
Dans ce cas, le résultat de la modification du volume est un quotient réactionnel plus petit que la constante d’équilibre, et donc l’équilibre se déplace vers la droite.
Ces résultats illustrent la relation entre la stœchiométrie d’un équilibre en phase gazeuse et l’effet d’un changement de pression (concentration) induit par le volume. Si les quantités molaires totales de réactifs et de produits sont égales, comme dans le premier exemple, une modification du volume ne déplace pas l’équilibre. Si les quantités molaires de réactifs et de produits sont différentes, une modification du volume déplace l’équilibre dans un sens qui “ adapte ” mieux le changement de volume. Dans le second exemple, trois moles de réactif (SO2 et O2) donnent deux moles de produit (SO3), et donc la diminution du volume du système provoque un déplacement de l’équilibre vers la droite puisque la réaction directe produit moins de gaz (2 mol) que la réaction inverse (3 mol). Inversement, l’augmentation du volume de ce système en équilibre entraînerait un déplacement vers les réactifs.
Ce texte a été adapté d’Openstax, Chimie 2e, Section 13.3 Déplacements d’équilibres : le principe de Le Chatelier.
