13.12:
Enzimas
68,972 Views
•
•
Dentro dos organismos vivos, as enzimas funcionam como catalisadores para muitas reações bioquímicas envolvidas no metabolismo celular. O papel das enzimas é reduzir as energias de ativação das reações bioquímicas através da formação de complexos com os seus substratos. A redução das energias de ativação favorece um aumento nas velocidades das reações bioquímicas.
As deficiências enzimáticas podem frequentemente traduzir-se em doenças que causam risco de vida. Por exemplo, uma anormalidade genética que resulta na deficiência da enzima G6PD (glicose-6-fosfato desidrogenase) afeta adversamente a via metabólica que fornece NADPH às células.
Uma interrupção nesta via metabólica pode reduzir a glutationa em glóbulos vermelhos causando danos em outras enzimas e proteínas como a hemoglobina. A metabolização excessiva da hemoglobina aumenta o nível de bilirrubina, o que leva à icterícia, condição que se pode tornar grave. Por isso, os povos que sofrem de deficiência em G6PD devem evitar determinados alimentos e medicamentos que contêm produtos químicos que poderiam provocar danos nos seus glóbulos vermelhos deficientes em glutationa.
Função e Estrutura Enzimática
As enzimas estão agrupadas em classes diferentes com base na função específica que desempenham. Por exemplo, oxidoredutases estão envolvidas em reações redox, enquanto que transferases catalisam a transferência de grupos funcionais. A formação de ligações com hidrólise de ATP requer ligases, enquanto que as reações de hidrólise e a formação de ligações duplas são catalisadas por hidrolases e liases, respectivamente. As enzimas isomerase normalmente catalisam reações de isomerização.
As enzimas geralmente possuem locais ativos. Estas são regiões específicas da molécula com uma conformação que favorece a ligação da enzima a um substrato específico (uma molécula de reagente) para formar um complexo enzima-substrato ou o intermediário da reação.
Dois modelos—o modelo de cadeado e chave e o modelo de adaptação induzida—tentam explicar o funcionamento de um local ativo (Figura 1). A hipótese mais simplista de cadeado e chave sugere que o local ativo e a forma molecular do substrato são complementares—encaixando-se um no outro como uma chave em um cadeado (Figura 1a). Por outro lado, a hipótese de adaptação induzida sugere que a molécula enzimática é flexível e muda de forma para acomodar uma ligação com o substrato (Figura 1b).
No entanto, tanto o modelo de cadeado e chave como o modelo de adaptação induzida são responsáveis pelo facto de as enzimas só se poderem ligar a substratos específicos e catalisar apenas uma reação específica.
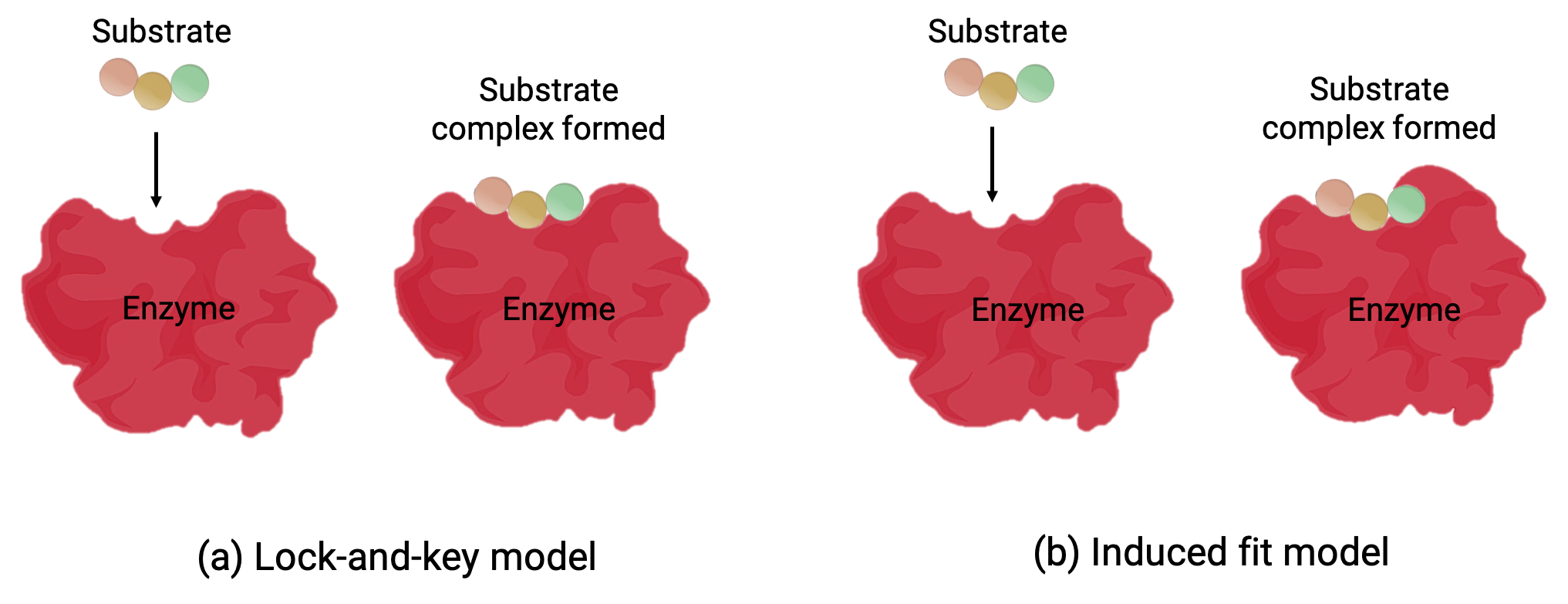
Figura 1 (a) De acordo com o modelo de cadeado e chave, a forma do local ativo de uma enzima é um encaixe perfeito para o substrato. (b) De acordo com o modelo de adaptação induzida, o local ativo é algo flexível, e pode mudar de forma para se ligar ao substrato.
Inibidores Enzimáticos
A atividade das enzimas também pode ser interrompida pelo processo de inibição enzimática. Existem vários tipos comuns de inibição enzimática.
Durante a inibição competitiva, uma molécula (natural ou sintética) que não o substrato liga-se diretamente ao local ativo da enzima. A semelhança estrutural e química do inibidor com o substrato facilita a sua ligação ao local ativo. Tais inibidores competitivos competem, assim, com substratos, impedindo-os de se ligarem à enzima. Frequentemente, o aumento da concentração do substrato pode suprimir os efeitos da inibição competitiva.
Na inibição não competitiva, uma molécula (natural ou sintética) liga-se a uma região alósterica (outra) da enzima, diferente do seu local ativo. A ligação do inibidor provoca uma alteração conformacional no local ativo da enzima, resultando em uma diminuição da capacidade da enzima catalisar a reação. Ao contrário da inibição competitiva, o aumento da concentração do substrato não atenua os efeitos inibitórios da inibição não competitiva.
Parte deste texto é adaptado de Openstax, Chemistry 2e, Section 12.7: Catalysis.
