13.12:
Enzimas
68,955 Views
•
•
Dentro de los organismos vivos, las enzimas actúan como catalizadores de muchas reacciones bioquímicas involucradas en el metabolismo celular. El papel de las enzimas es reducir las energías de activación de las reacciones bioquímicas formando complejos con sus sustratos. La disminución de las energías de activación favorece un aumento en las velocidades de las reacciones bioquímicas.
Las deficiencias enzimáticas a menudo pueden traducirse en enfermedades que ponen en peligro la vida. Por ejemplo, una anomalía genética que resulta en la deficiencia de la enzima G6PD (glucosa-6-fosfato deshidrogenasa) afecta negativamente la vía metabólica que suministra NADPH a las células.
Una interrupción en esta vía metabólica puede reducir el glutatión en los glóbulos rojos causando daño a otras enzimas y proteínas como la hemoglobina. La metabolización excesiva de la hemoglobina aumenta el nivel de bilirrubina, lo que lleva a la ictericia, una afección que puede volverse grave. Por lo tanto, las personas que sufren de deficiencia de G6PD deben evitar ciertos alimentos y medicamentos que contienen productos químicos que podrían desencadenar daños a sus glóbulos rojos deficientes en glutatión.
Función y estructura enzimática
Las enzimas se agrupan en diferentes clases basándose en la función específica que realizan. Por ejemplo, las oxidoreductasas están involucradas en reacciones redox, mientras que las transferasas catalizan la transferencia de grupos funcionales. La formación de enlaces con hidrólisis de ATP requiere ligasas, mientras que las reacciones de hidrólisis y la formación de enlaces dobles son catalizadas por hidrolasas y ligasas, respectivamente. Las enzimas de isomerasa generalmente catalizan reacciones de isomerización.
Las enzimas generalmente poseen sitios activos. Estas son regiones específicas en la molécula con una conformación que favorece la unión de la enzima con un sustrato específico (una molécula reactante) para formar un complejo enzima-sustrato o el intermediario de la reacción.
Dos modelos—el modelo de llave y cerradura y el modelo de ajuste inducido—intentan explicar el funcionamiento de un sitio activo (Figura 1). La hipótesis más simplista de llave y cerradura sugiere que el sitio activo y la forma molecular del sustrato son complementarios, ajustándose como una llave en una cerradura (Figura 1a). Por otro lado, la hipótesis de ajuste inducido sugiere que la molécula enzimática es flexible y cambia de forma para adaptarse a la unión con el sustrato (Figura 1b).
Sin embargo, tanto el modelo de llave y cerradura como el modelo de ajuste inducido explican el hecho de que las enzimas sólo pueden unirse con sustratos específicos y catalizar sólo una reacción en particular.
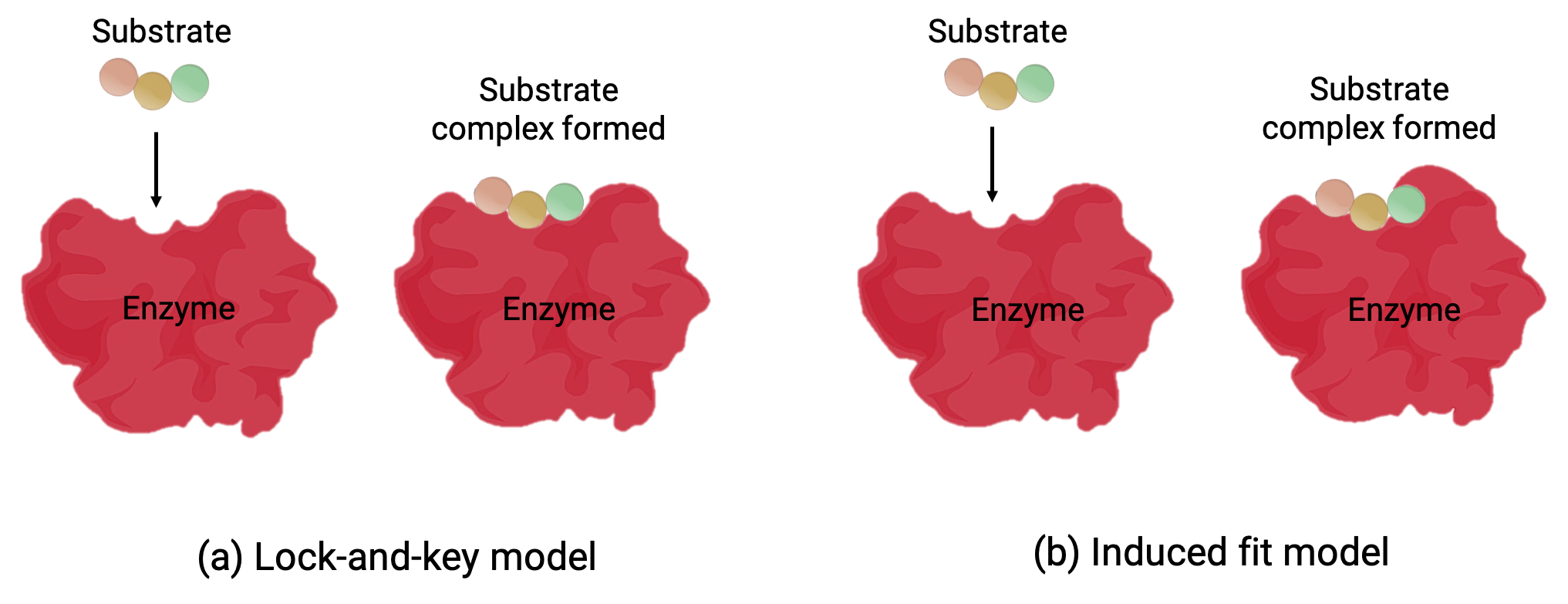
Figura 1 (a) Según el modelo de llave y cerradura, la forma del sitio activo de una enzima se ajuste perfectamente al sustrato. (b) De acuerdo con el modelo de ajuste inducido, el sitio activo es algo flexible, y puede cambiar de forma para unirse con el sustrato.
Inhibidores enzimáticos
La actividad de las enzimas también puede ser interrumpida por el proceso de inhibición enzimática. Existen varios tipos comunes de inhibición enzimática.
Durante la inhibición competitiva, una molécula (natural o sintética) que no sea el sustrato se une directamente al sitio activo de la enzima. La similitud estructural y química del inhibidor con el sustrato facilita su unión al sitio activo. Tales inhibidores competitivos, por lo tanto, compiten con los sustratos, evitando que se vinculen a la enzima. Con más frecuencia, el aumento de la concentración de sustrato puede suprimir los efectos de la inhibición competitiva.
En la inhibición no competitiva, una molécula (natural o sintética) se une a una región alostérica (otra) de la enzima, diferente de su sitio activo. La unión a los inhibidores causa un cambio conformacional en el sitio activo de la enzima, resultando en una disminución en la capacidad de la enzima para catalizar la reacción. A diferencia de la inhibición competitiva, un aumento en la concentración de sustrato no mitiga los efectos inhibitorios de la inhibición no competitiva.
Parte de este texto está adaptado de Openstax, Química 2e, Sección 12.7: Catálisis.
