6.8:
Калориметрия постоянного давления
77,419 Views
•
•
Калориметрия — это метод, используемый для измерения количества тепла, выделенного в химическом или физическом процессе, или для измерения температуры, передаваемой веществу или из него. Тепло обменивается калиброванным и изолированным устройством, называемым калориметром. Эксперименты с калориметрией основаны на предположении, что теплообмен между изолированным калориметром и внешней средой отсутствует. Хорошо изолированные калориметры предотвращают передачу тепла между калориметром и его внешней средой, что эффективно ограничивает «окружение» несистемными компонентами в пределах калориметра (и самого калориметра). Это позволяет точно определить температуру, которая используется в химических процессах, например, содержание энергии в продуктах.
Изменение температуры, измеренное калориметром, используется для получения количества тепла, передаваемого исследуемым процессом. В калориметре система определяется как вещество или вещества, претерпеющие химические или физические изменения, или, другими словами, реакция, а вокруг все остальные вопросы, включая раствор и любые другие компоненты в калориметре, которые либо обеспечивают тепло системе, либо поглощают тепло из системы.
Перед обсуждением калориметрии химических реакций рассмотрите более простой пример, иллюстрирующий основную идею калориметрии. Предположим, что горячий кусок металла при высокой температуре помещается в низкотемпературное вещество, например, в прохладную воду. Тепло будет поступать из горячего металла в воду. Температура металла снизится, а температура воды будет повышаться до тех пор, пока два вещества не нагреются до той же температуры, то есть, когда они достигнут теплового равновесия. Если это происходит в калориметре, все тепло переносится между двумя веществами, без нагрева, получаемого или теряемого его внешней средой. В этих идеальных условиях изменение температуры в сети равно нулю:
Это отношение можно изменить, чтобы показать, что тепло, получаемое металлом, равно теренному веществом теренному воздействию воды:
Таким образом, количество тепла (изменения) одинаково для обоих веществ. Отрицательный знак просто показывает, что qmetal и qwater противоположны в направлении потока тепла (усиление или потеря), но не указывает арифметический знак значения q (который определяется тем, получает ли рассматриваемое дело или теряет тепло, в соответствии с определением). В конкретной ситуации qmetal является отрицательным значением, и qwater является положительным значением, так как тепло переносится из металла в воду.
При использовании калориметрии для определения температуры, участвующей в химической реакции, применяются те же принципы. Количество тепла, поглощенного калориметром, часто достаточно мало, чтобы его чаще всего можно было игнорировать, а калориметр минимизирует обмен энергии с внешней средой. При экзотермической реакции в раствор в калориметре тепло, выделенное реакцией, поглощается раствор, что повышает его температуру. При возникновении эндотермической реакции необходимое тепло поглощается тепловой энергией раствор, что снижает его температуру. Изменение температуры (ΔT), а также удельным теплом (csoln) и массой раствор (msoln) могут затем использоваться для расчета количества тепла (qsoln), которое используется в любом случае.
Простой калориметр, называемый калориметром чашки кофе, изготовлен из двух вложенных стаканов из полистирола, закрытых крышкой, свободной от подгонки. Калориметры чашек кофе используются для измерения температуры реакций, которые происходят в растворах (в основном водных растворах) и не требуют изменения объема. Поскольку энергия не создается и не уничтожается во время химической реакции, тепло, выделенное или потребное в реакции («система»), qrxn, плюс тепло, поглощенное или теренное раствор («окружающая среда»), qsoln, должно прибавляваться к нулю:
Это означает, что количество тепла, выделенное или израсходованное в результате реакции, равно количеству тепла, поглощенного или теренного раствор:
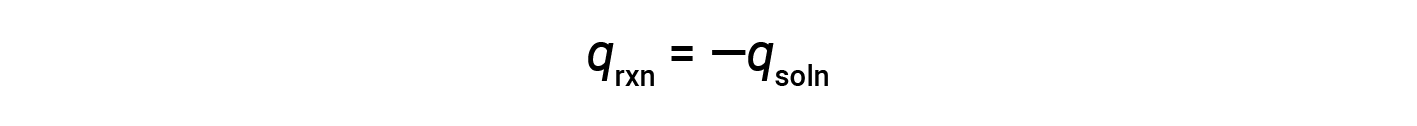
Калориметр чашки кофе представляет собой калориметр постоянного давления, а измеренная температура реакции эквивалентна изменению энтальпии.

Этот текст адаптирован из Openstax, Химия 2е изд., раздел 5.2: Калориметрия.
