17.5:
Cambio de Entropía Estándar para una Reacción
16,726 Views
•
•
La entropía es una función de estado, por lo que el cambio de entropía estándar para una reacción química (ΔS°rxn) se puede calcular a partir de la diferencia de entropía estándar entre los productos y los reactivos.
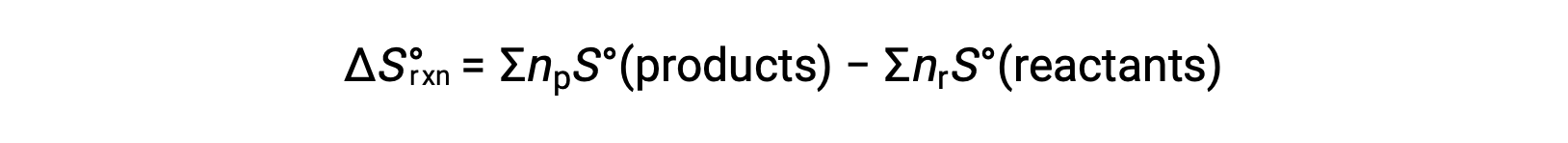
donde np y nr representan los coeficientes estequiométricos en la ecuación balanceada de los productos y los reactivos, respectivamente.
Por ejemplo, ΔS°rxn para la siguiente reacción a temperatura ambiente
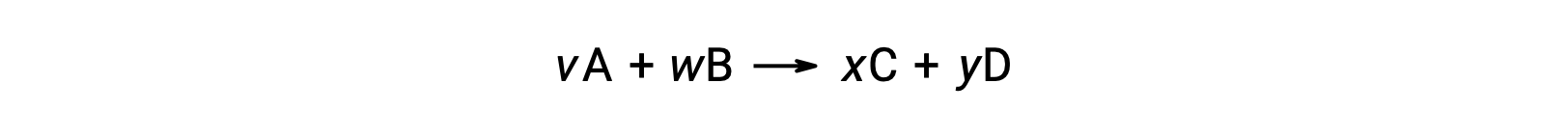
se calcula de la siguiente manera:
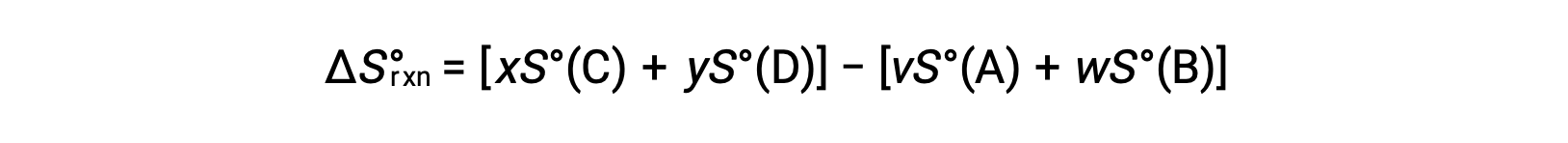
En la tabla se proporciona una lista parcial de entropías estándar.
| Sustancia | S° (J/mol·K) |
| C (s, grafito) | 5,740 |
| C (s, diamante) | 2,38 |
| CO (g) | 197,7 |
| CO2g) | 213,8 |
| CH4g) | 186,3 |
| C2H4 (g) | 219,5 |
| C2H6 (g) | 229,5 |
| CH3OH(l) | 126,8 |
| C2H5OH (l) | 160,7 |
| H2g) | 130,57 |
| H (g) | 114,6 |
| H2O (g) | 188,71 |
| H2O (l) | 69,91 |
| HCI (g) | 186,8 |
| H2S (g) | 205,7 |
| O2 (g) | 205,03 |
Determinación de ÄS°
Considere la condensación del agua, en la que 1 mol de H se convierte en 1 mol de líquido H2O.
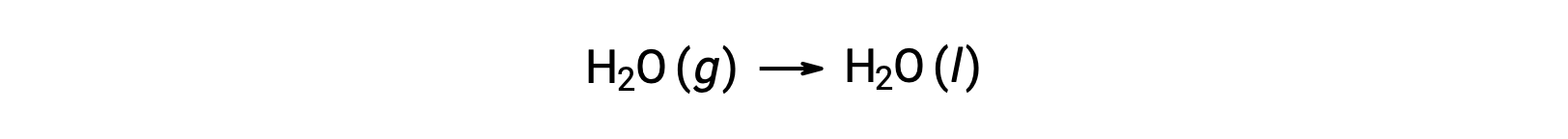
La entropía estándar cambia para la reacción, ΔS°rxn se calcula utilizando las entropías molares estándar y los coeficientes estequiométricos.
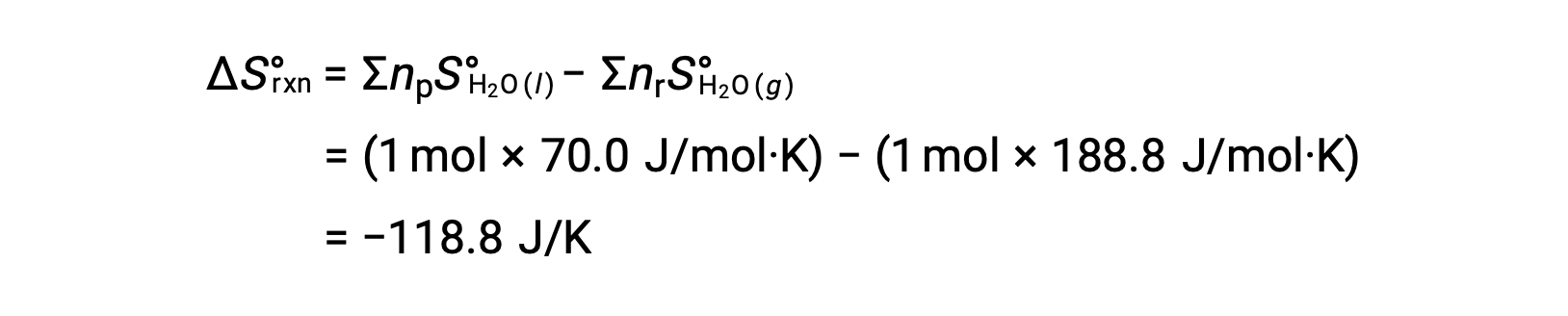
El valor de ÄS°rxn es negativo, como se espera para esta transición de fase (condensación).
Como segundo ejemplo, considere la combustión del metanol, CH3OH:
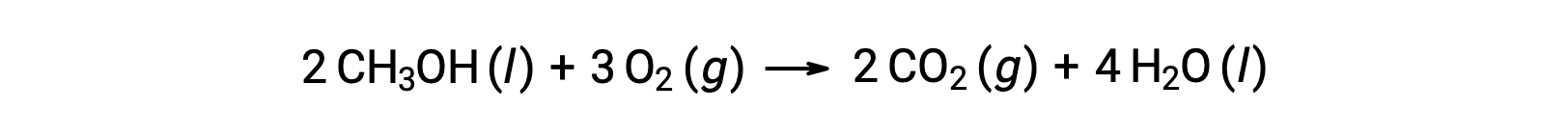
Se sigue el mismo procedimiento para calcular el cambio de entropía estándar de la reacción:
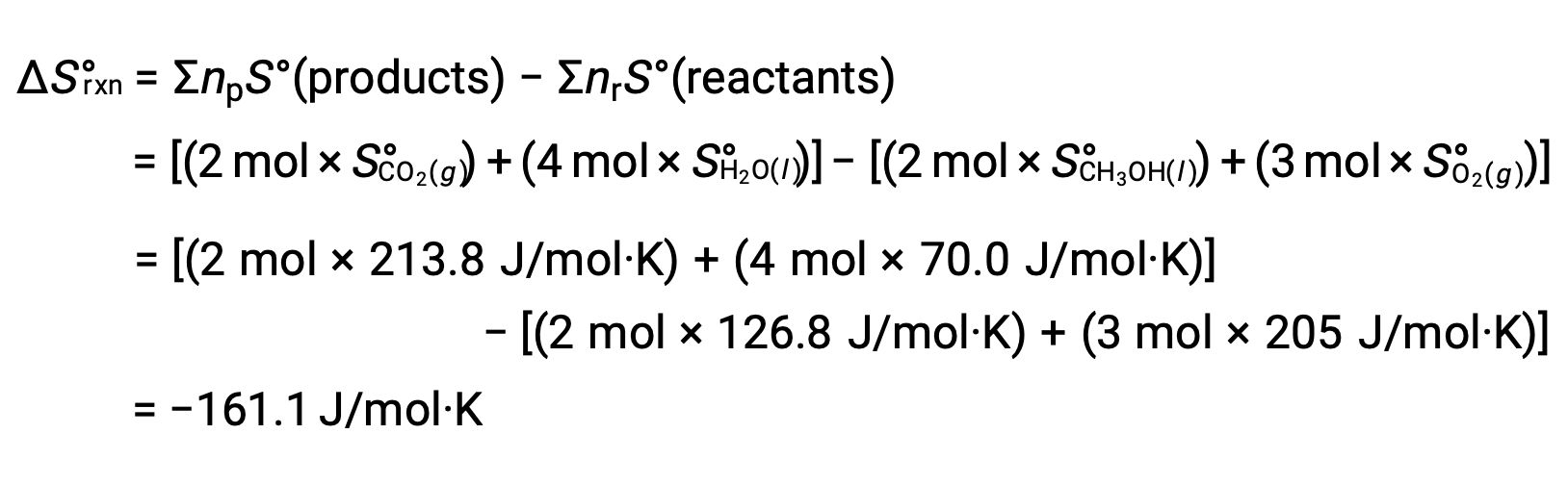
Este texto es adaptado de Openstax, Química 2e, Capítulo 16.2: La Segunda y Tercera Ley de la Termodinámica.
