6.12:
反应焓
27,860 Views
•
03:33 min
•
September 03, 2020
如果可以得到相应的反应物和产物的生成焓,则可以使用赫斯定律来确定任何反应的焓变。主要反应可分为逐步反应:(i)反应物分解成其组成元素,其焓变与反应物形成焓的负数成正比,−ΔHf°(反应物),然后(ii)重新组合元素(在步骤1中获得),得到产物,其焓变与生成的焓成正比。产品 ΔHf°(产物)。因此,整个反应的标准焓变等于:(ii)所有产物形成的标准焓之和加上(i)反应物形成的标准焓的负数之和,由下式给出:以下等式,其中∑代表“之总和” n 代表化学计量系数。
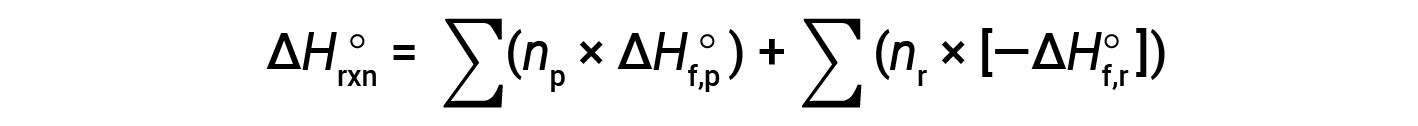
通常将等式重新排列为以下形式:
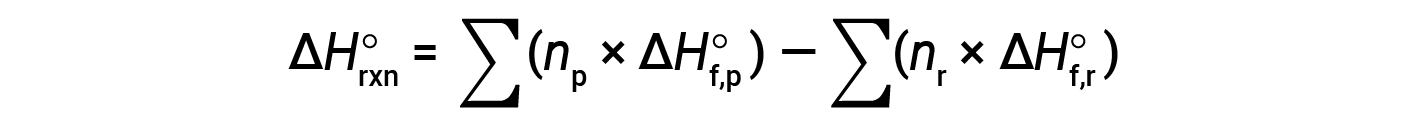
以下示例详细显示了此方程为何有效以及如何使用该方程计算反应的标准焓变:

在此,使用赫斯定律的特殊形式以及反应物和产物的形成热值: ΔHf° (HNO3) = −206.64 kJ/mol; ΔHf° (NO) = +90.2 kJ/mol; ΔHf° (NO2) = +33 kJ/mol; ΔHf° (H2O) = −285.8 kJ/mol.


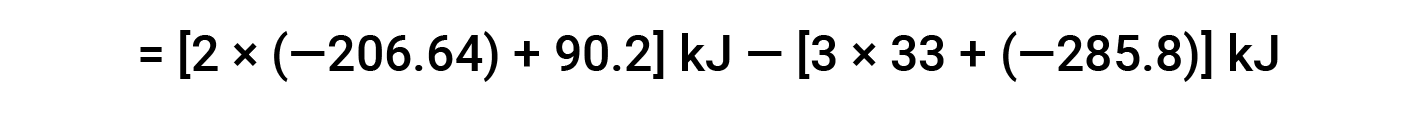
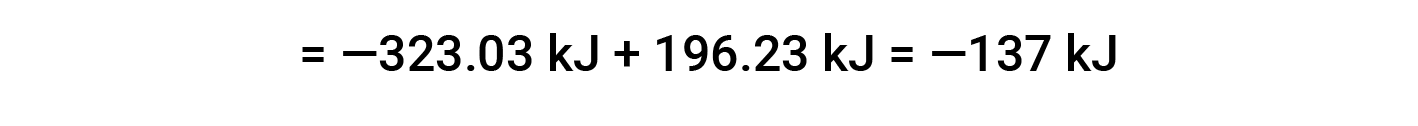
本文改编自 Openstax,化学2e,第5.3节:焓。
