15.10:
Ионы как кислоты и основания
21,374 Views
•
•
Соли с кислотными ионами
Соли представляют собой ионные соединения, состоящие из катионов и анионов, которые могут проходить кислотную или ионизационную реакцию основание с водой. Поэтому водные солевые растворы могут быть кислотными, основными или нейтральными, в зависимости от относительных кислотно-основная-сильных сторон составляющих ионов соли. Например, растворение хлорида аммония в воде приводит к его диссоциации, как описано в уравнении:
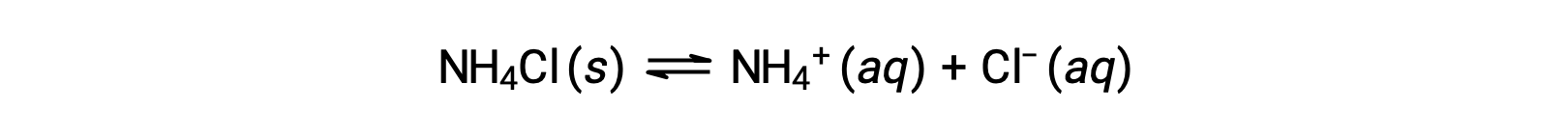
Ион аммония — это конъюгатная кислота аммиака основание, NH3; его кислотная ионизация (или гидролиз кислоты) — реакция
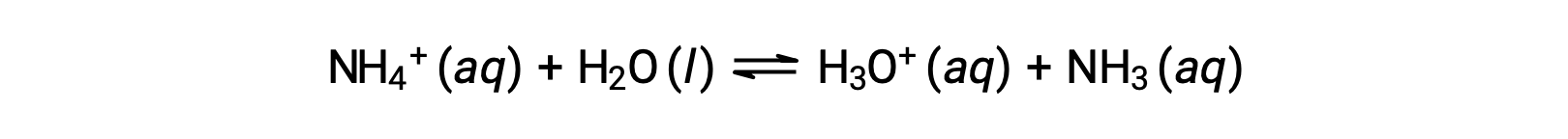
Так как аммиак является слабым основание, Kb можно измерить и Ka > 0 (ион аммония является слабой кислотой).
Хлорид-ион является конъюгатом основание соляной кислоты, и поэтому его реакция ионизации основание (или гидролиза основание) представлена
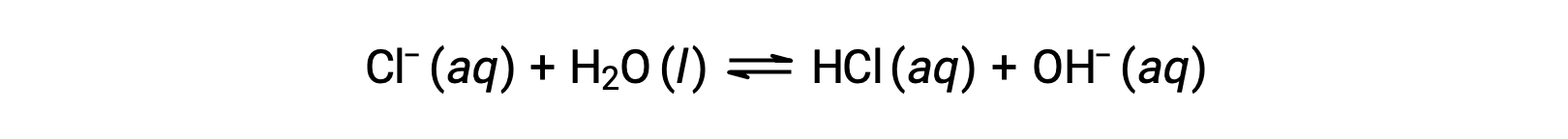
Поскольку ГХЛ является сильной кислотой, Ка неизмеримо крупнее и Кбайт ≈ 0 (ионы хлорида не подвергаются заметному гидролизу). Таким образом, растворение хлорида аммония в воде приводит к образованию раствор из слабых кислотных катионов (NH4+) и инертных анионов (CL–), что приводит к образованию кислого раствор.
Соли с основными ионами
В качестве другого примера рассмотрим растворение ацетата натрия в воде:
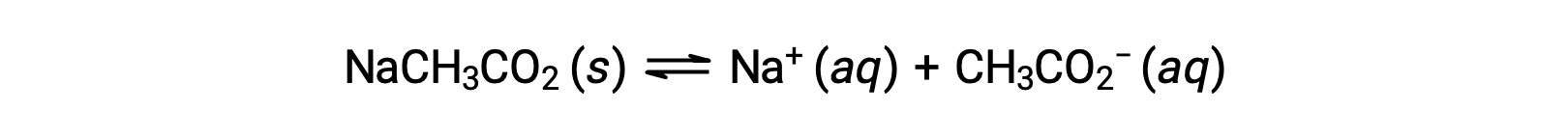
Натрий-ион не подвергается значительной кислоте или ионизации основание и не оказывает влияния на pH раствор. Это может показаться очевидным из формулы иона, которая указывает на отсутствие атомов водорода или кислорода, но некоторые ионы растворенного металла функционируют как слабые кислоты, о чем говорится далее в этом разделе. Ацетатный ион CH3CO2 – это конъюгатный основание уксусной кислоты CH3CO2H, и поэтому его реакция ионизации основание (или гидролиза основание) представлена
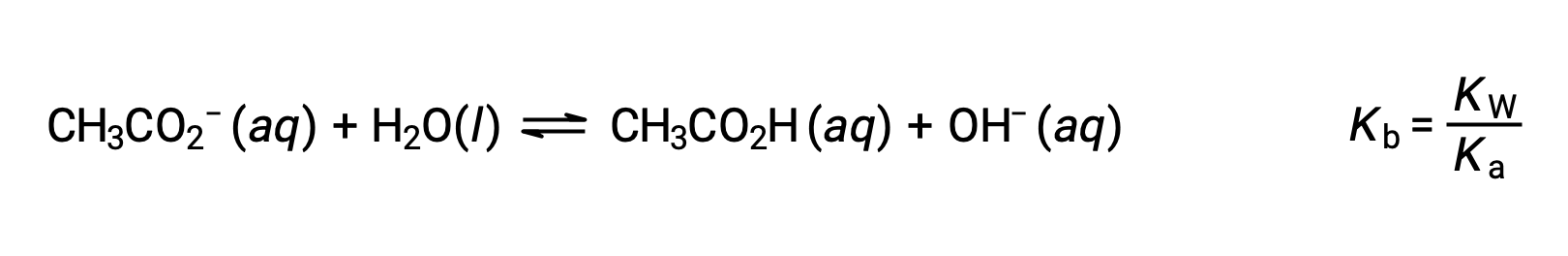
Поскольку уксусная кислота является слабой кислотой, ее Ка измерима и Кбайт > 0 (ацетатный ион является слабым основание). Растворение ацетата натрия в воде приводит к образованию раствор инертных катионов (Na+) и слабых анионов основание (CH3CO2–), в результате чего получается основной раствор.
Соли с кислотными и основными ионами
Некоторые соли состоят из кислых и основных ионов, поэтому рН их растворов будет зависеть от относительной прочности этих двух видов. Для таких типов солей сравнение значений Ка и Кбайт позволяет прогнозировать состояние решения кислотно-основная.
Ионизация ионов гидратированного металла
В отличие от группы 1 и 2 ионов металлов предыдущих примеров (Na+, Ca2+ и др.), некоторые ионы металлов функционируют как кислоты в водных растворах. Эти ионы не просто разрешимости молекулами воды при растворении; вместо этого они ковалентно связаны с фиксированным количеством молекул воды, чтобы получить комплексный ион (см. главу о химии координации). Например, растворение нитрата алюминия в воде обычно представлено как

Тем не менее, ион алюминия(III) фактически вступает в реакцию с шестью молекулами воды, образуя стабильный сложный ион, и таким образом, более явное представление процесса растворения является
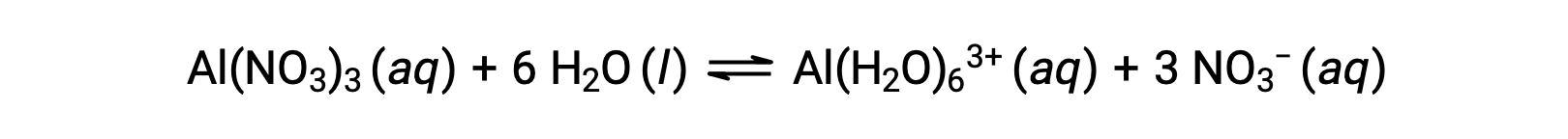
Ионы Al(H2O)63+ связаны между центральным атомом Al и атомами O шести молекул воды. Следовательно, связи O–H молекул связанной воды более полярны, чем в молекулах неукрепленной воды, что делает связанные молекулы более склонными к пожертвованию иона водорода:
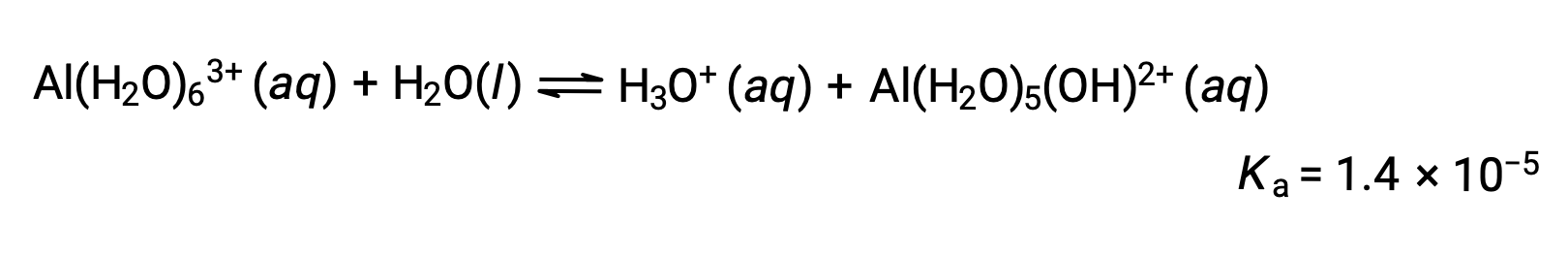
Сопряженный основание, производимый этим процессом, содержит пять других связанных молекул воды, способных действовать в качестве кислот, и поэтому возможен последовательный или пошаговый перенос протонов, как показано ниже в нескольких уравнениях:
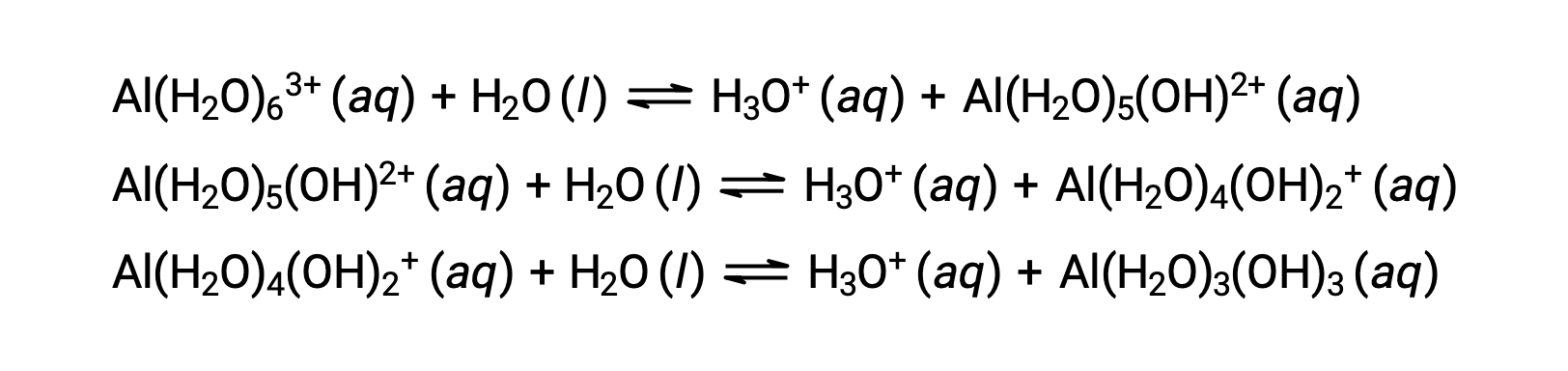
Помимо щелочных металлов (группа 1) и некоторых щелочных металлов (группа 2), большинство других ионов металлов будут подвергаться кислотной ионизации в некоторой степени при растворении в воде. Кислотная прочность этих комплексных ионов обычно увеличивается с увеличением заряда и уменьшением размера ионов металлов. Ниже приведены уравнения ионизации кислотной кислоты для нескольких других ионов кислотного металла:
| Уравнения ионизации первого шага | ПКа |
| FE(H2O)63+ (aq) + H2O (l) ⇌ H3O+ (aq) + Fe(H2O)5(OH)2+ (aq) | 2.74 |
| CU(H2O)62+ (aq) + H2O (l) ⇌ H3O+ (aq) + Cu(H2O)5(OH)+ (aq) | ~6.3 |
| Zn(H2O)42+ (aq) + H2O (l) ⇌ H3O+ (aq) + Zn(H2O)3(OH)+ (aq) | 9.6 |
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.4: Гидролиз солей.
