14.2:
Константа равновесия
39,349 Views
•
•
Рассмотрим окисление диоксида серы:
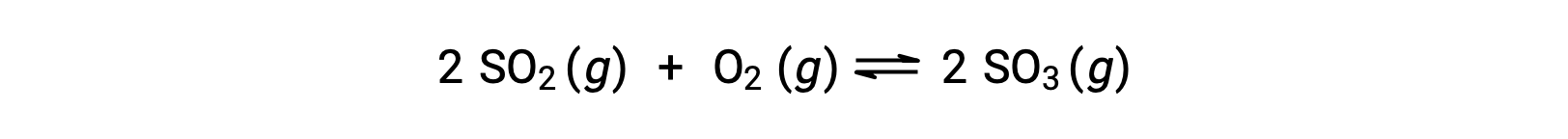
Для реакции, которая начинается только с смеси реагенты, концентрация продукта изначально равна нулю. По мере того как реакция движется к равновесию в прямом направлении, концентрации реагент уменьшаются и концентрация продукта увеличивается. При достижении равновесия концентрации реагенты и продуктов остаются неизменными.
Если реакция начинается только с присутствующих продуктов, то реакция идет к равновесию в обратном направлении. Концентрация продукта со временем снижается, а концентрации реагент увеличиваются до тех пор, пока концентрации не станут постоянными в равновесии.
Закон массового действия гласит, что отношение концентрации продуктов к концентрации реагенты при равновесии, поднятое до их соответствующих стехиометрических коэффициентов, равно константе, называемой равновесной константой, K или Kc.
Таким образом, выражение константы равновесия для вышеуказанной реакции записывается как:
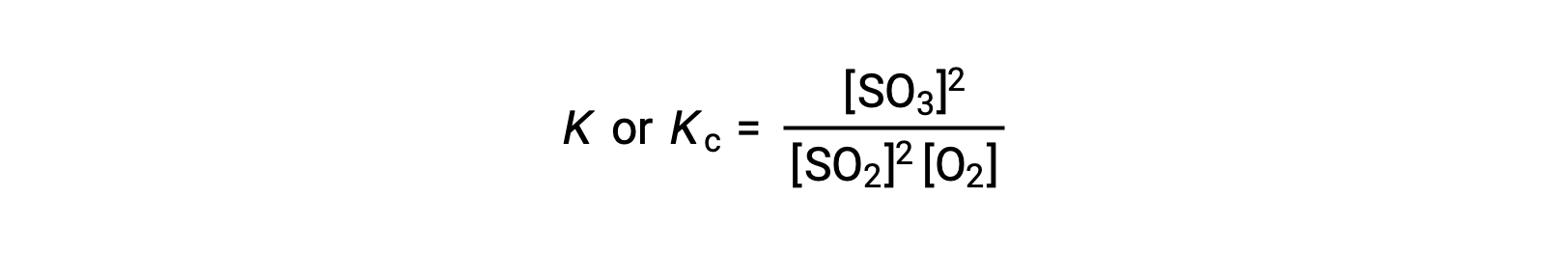
где, подстрочная буква “c” означает, что равновесная константа учитывает молярную концентрацию реагенты и продуктов.
Величина равновесной константы явно отражает состав реакционной смеси при равновесии. Реакция, проявляющая большой K, достигнет равновесия, когда большая часть реагент будет преобразована в продукт, в то время как небольшой K указывает на то, что реакция достигает равновесия после того, как было преобразовано очень мало реагент. Важно помнить, что величина K не показывает, насколько быстро или медленно будет достигнуто равновесие. Некоторые равновесии устанавливаются так быстро, что практически мгновенно, а другие настолько медленно, что в течение нескольких дней, лет или дольше не наблюдается никаких заметных изменений. Константа равновесия для реакции может использоваться для прогнозирования поведения смесей, содержащих реагенты и/или продукты. Как показывает описанный выше процесс окисления диоксида серы, химическая реакция будет протекаться в любом направлении, необходимом для достижения равновесия.
Спаренное равновесие
Многие равновесные системы включают две или более связанных равновесных реакций, которые имеют общее одно или несколько видов реагент или продуктов. Значение K для системы, в которой используется спаренное равновесие, может быть связано со значениями K для отдельных реакций. В этом подходе задействованы три основные манипуляции, как описано ниже:
• Изменение направления химического уравнения по существу меняет идентичность “реагенты” и “продуктов”, и поэтому константа равновесия для обратного уравнения является просто обратной от этой константы для уравнения движения вперед.
• Изменение стехиометрических коэффициентов в уравнении на какой-то коэффициент x приводит к экспоненциальному изменению константы равновесия на тот же коэффициент.
• сложение двух или более уравнений равновесия дает общее уравнение, константа равновесия которого является математическим продуктом значений K индивидуальной реакции .
Выражение константы равновесия для гетерогенного равновесия
Для гетерогенного равновесия, включающего реагенты и продукты в двух или более разных фазах, концентрации чистых твердых веществ или чистых жидкостей не включаются в выражение константы равновесия, как показано на следующем примере:

Это связано с тем, что относительные концентрации чистых жидкостей и чистых твердых веществ остаются постоянными во время реакции.
Этот текст был адаптирован из Openstax, Химия 2е изд., раздел 13.2 равновесные константы.
