14.5:
Cociente de Reacción
43,254 Views
•
•
El estado de una reacción reversible se verifica convenientemente evaluando su cociente de reacción (Q). Para una reacción reversible descrita por mA + nB ⇌ xC + yD, el cociente de reacción se deriva directamente de la estequiometría de la ecuación balanceada como
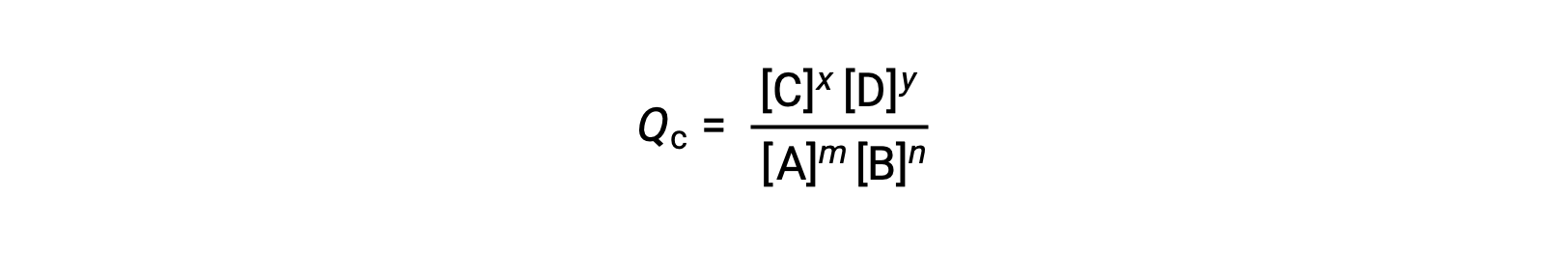
donde el subíndice c denota el uso de concentraciones molares en la expresión. Si los reactivos y los productos son gaseosos, un cociente de reacción puede obtenerse de forma similar utilizando presiones parciales:
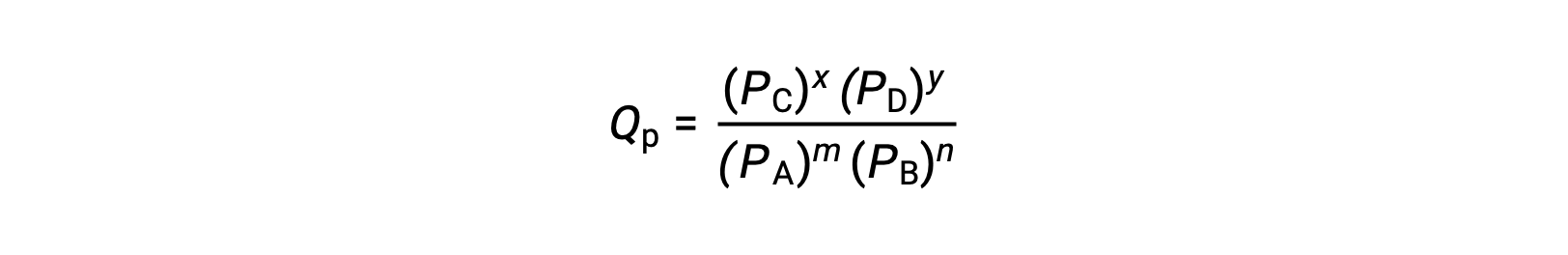
Tenga en cuenta que las ecuaciones de cociente de reacción anteriores son una simplificación de expresiones más rigurosas que utilizan valores relativos para concentraciones y presiones en lugar de valores absolutos. Estos valores relativos de concentración y presión no tienen dimensiones (no tienen unidades); por consiguiente, tampoco los cociente de reacción.
El valor numérico de Q varía a medida que una reacción avanza hacia el equilibrio; por lo tanto, puede servir como indicador útil del estado de la reacción. Para ilustrar este punto, considere la oxidación del dióxido de azufre:
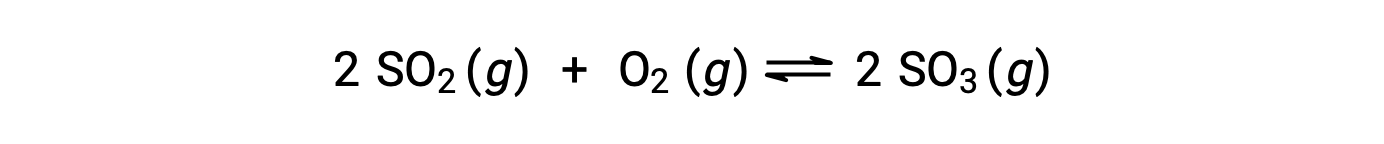
Aquí son posibles dos escenarios experimentales diferentes, uno en el que esta reacción se inicia solamente con una mezcla de reactivos, SO2 y O2, y otro que comienza solamente con un producto, SO3. Para la reacción que comienza solamente con una mezcla de reactivos, Q es inicialmente igual a cero:
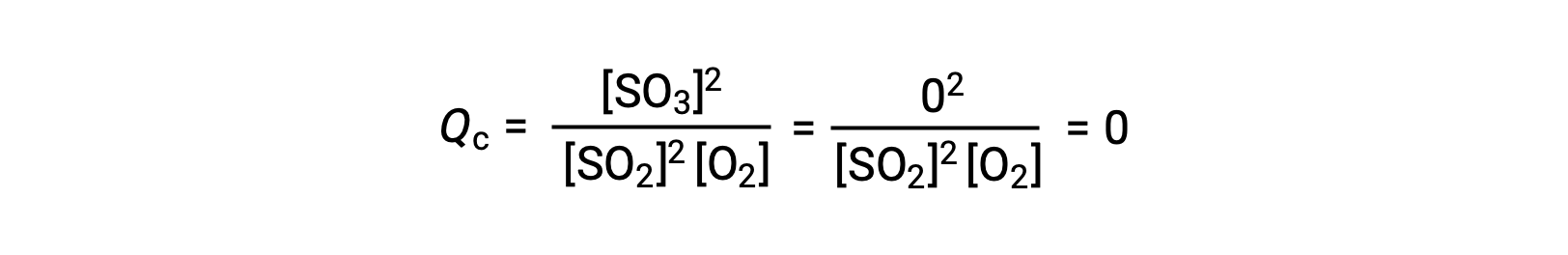
A medida que la reacción avanza hacia el equilibrio en la dirección de avance, las concentraciones de los reactivos disminuyen (al igual que el denominador del Qc), la concentración del producto aumenta (al igual que el numerador del Qc) y el cociente de reacción aumenta consecuentemente. Cuando se alcanza el equilibrio, las concentraciones de los reactivos y del producto permanecen constantes, al igual que el valor del Qc.
Si la reacción comienza sólo con el producto presente, el valor de Qc no está definido inicialmente (inmensurablemente grande o infinito):
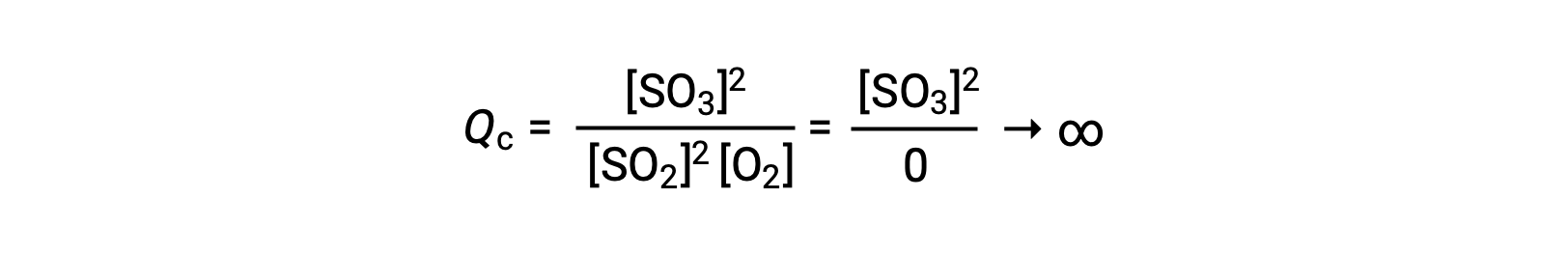
En este caso, la reacción avanza hacia el equilibrio en la dirección inversa. La concentración del producto y el numerador del Qc disminuyen con el tiempo, las concentraciones de reactivos y el denominador del Qc aumentan, y el cociente de reacción disminuye consecuentemente hasta que se vuelve constante en equilibrio. El valor constante de Q mostrado por un sistema en equilibrio se denomina constante de equilibrio, K:
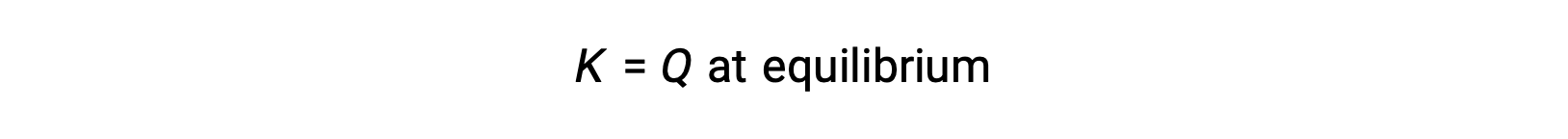
Evaluando un cociente de reacción
El dióxido de nitrógeno gaseoso forma tetróxido de dinitrógeno de acuerdo con la siguiente ecuación:
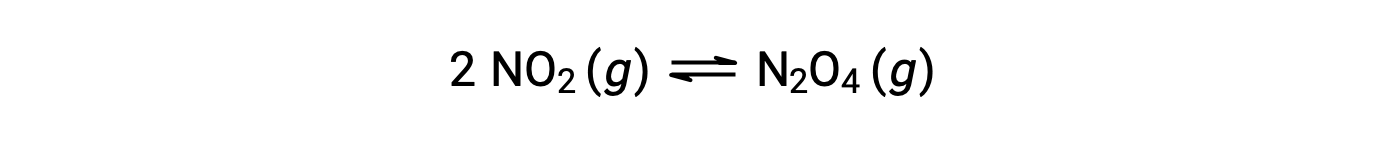
Cuando se añaden 0,10 mol de NO2 a un matraz de 1,0 l a 25 °C, la concentración cambia de modo que, en equilibrio, [NO2] = 0,016 M y [N2O4] = 0,042 M. Antes de la formación de cualquier producto, [NO2] = 0,10 M y [N2O4] = 0 M.
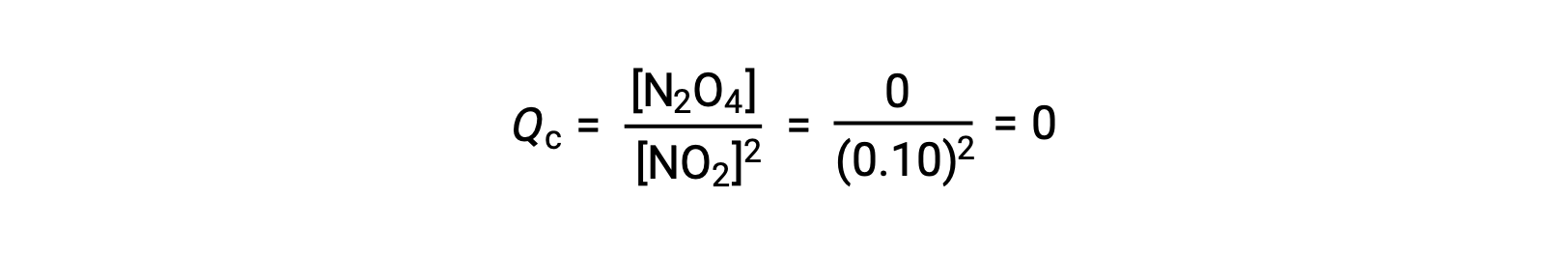
En equilibrio,
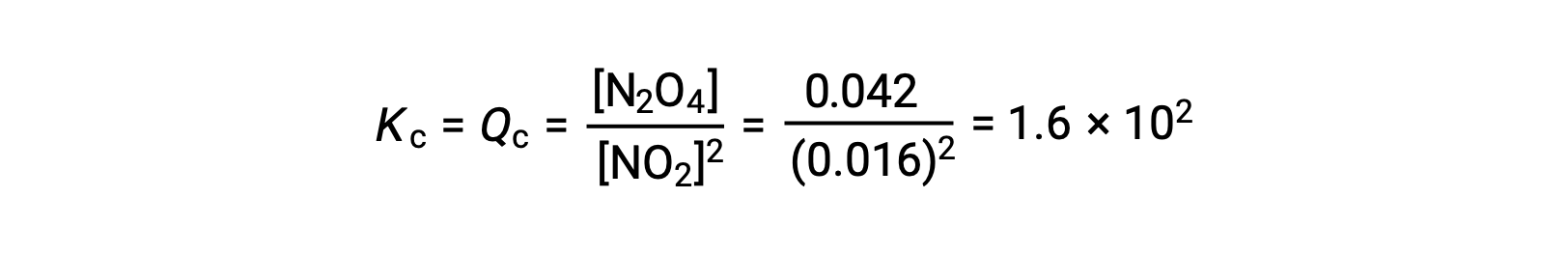
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.2 Las Constantes de Equilibrio.
