12.6:
Çözünürlüğü Etkiliyen Fiziksel Özellikler
18,972 Views
•
•
Sıvılardaki Gaz Çözeltileri
Herhangi bir çözeltide olduğu gibi, bir sıvıdaki bir gazın çözünürlüğü, çözünen ve çözücü türleri arasındaki çekici moleküller arası kuvvetlerden etkilenir. Bununla birlikte, katı ve sıvı çözünen maddelerden farklı olarak, bir gaz içeren atomlar veya moleküller çok uzak olduğundan ve ihmal edilebilir etkileşimler yaşadığından, gaz halindeki bir çözünen sıvı bir çözücü içinde çözüldüğünde üstesinden gelinmesi gereken bir çözünen-çözünen moleküller arası çekim yoktur. Sonuç olarak, çözücü-çözücü etkileşimleri, çözünürlüğü etkileyen tek enerjik faktördür. Örneğin, oksijenin suda çözünürlüğü, helyumunkinden yaklaşık üç kat daha büyüktür (su ve daha büyük oksijen molekülleri arasında daha büyük dağılım kuvvetleri vardır), ancak klorometan, CHCl3‘nin çözünürlüğünden 100 kat daha azdır (polar klorometan molekülleri dipol-dipol ile karşılaşır. polar su moleküllerine çekim). Benzer şekilde, C6H14 heksan içindeki oksijenin çözünürlüğünün sudaki çözünürlüğünden yaklaşık 20 kat daha fazla olduğuna dikkat edin, çünkü oksijen ve daha büyük hekzan molekülleri arasında daha büyük dispersiyon kuvvetleri mevcuttur.
Çözünürlüğü etkileyen başka bir faktör sıcaklıktır ve gaz çözünürlüğü tipik olarak sıcaklık arttıkça düşer. Sıcaklık ve çözünmüş gaz konsantrasyonu arasındaki bu ters ilişki, doğal sulardaki termal kirliliğin en önemli etkilerinden biridir.
Gaz halindeki bir çözünen maddenin çözünürlüğü, çözeltinin maruz kaldığı gazdaki kısmi çözünen basınçtan da etkilenir. Gazın basıncı arttıkça gazın çözünürlüğü artar.
Çoğu gaz halindeki çözünen maddeler için çözünürlük, Sgas ve kısmi basınç Pgas arasındaki ilişki orantılıdır:
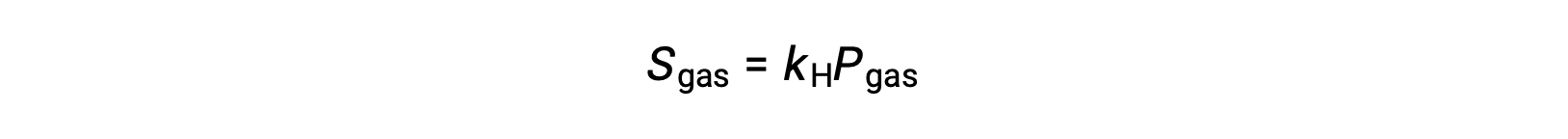
kH, gaz halindeki çözünen madde ve çözücünün kimliklerine ve çözelti sıcaklığına bağlı olan bir orantı sabitidir. Bu Henry yasasının matematiksel bir ifadesidir: Belirli bir sıvı hacminde çözünen ideal bir gazın miktarı, gazın basıncıyla doğru orantılıdır.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 11.3: Solubility.
