15.12:
Полипротонные кислоты
24,765 Views
•
•
Кислоты классифицируются по количеству протонов на молекулу, которые они могут отказаться в реакции. Кислоты, такие как HCl, HNО3 и HCN, содержащие один ионуцируемый атом водорода в каждой молекуле, называются монопростическими кислотами. Их реакции с водой:
| Монопростические кислоты: Реакции с водой |
| HCl (aq) + H2O (l) ⟶ H3O+ (aq) + Cl– (aq) |
| HNО3 (aq) + H2O (l) ⟶ H3O+ (aq) + NО3– (aq) |
| HCN (aq) + H2O (l) ⇌ H3O+ (aq) + CN– (aq) |
Даже если он содержит четыре атома водорода, уксусная кислота, CH3CO2H, также является монопростическим, потому что только атом водорода из карбоксильной группы (COOH) реагирует с основаниями:
Аналогично, монопротические основания являются основаниями, которые принимают один протон.
Дипротические кислоты содержат два ионируемых атома водорода на молекулу; ионизация таких кислот происходит в два этапа. Первая ионизация всегда происходит в большей степени, чем вторая ионизация. Например, серная кислота, сильная кислота, ионизируется следующим образом:
| Дипротическая кислота: Серная кислота (H2SO4) | ||
| 1-я ионизация | H2SO4 (aq) + H2O (l) ⇌ H3O+ (aq) + HSO4− (aq) | KA1 = более 102; полная диссоциация |
| 2-я ионизация | HSO4– (aq) + H2O (l) ⇌ H3O+ (aq) + SO42– (aq) | KA2 = 1.2 × 10-2 |
Этот поэтапный процесс ионизации происходит для всех полипроптических кислот. Карбоновая кислота, H2CO3, является примером слабой диметической кислоты. Первая ионизация карбоновой кислоты приводит к образованию ионов гидрония и ионов бикарбоната в небольших количествах.
Первая ионизация: H2CO3 (aq) + H2O (l) ⇌ H3O+ (aq) + HCO3– (aq)
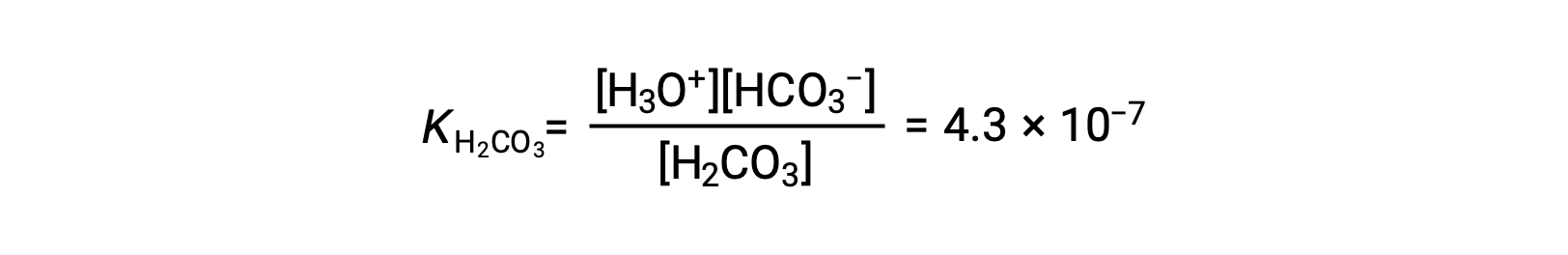
Бикарбонат-ион также может выступать в качестве кислоты. Он ионизирует и образует ионы гидрония и карбонатные ионы в еще меньших количествах.
Вторая ионизация: HCO3– (aq) + H2O (l) ⇌ H3O+ (aq) + CO32– (aq)

KH2CO3 больше, чем KHCO3– в 104 раз, поэтому H2CO3 является доминирующим производителем гидрония иона в раствор. Это означает, что при ионизации H2CO3 происходит ионизация ионов гидрония (и ионов карбоната), а концентрации H3O+ и HCO3 практически равны в чистом водном раствор растворе H2CO3.
Если первая константа ионизации слабой диметической кислоты больше второй в 20 раз, то следует обработать первую ионизацию отдельно и рассчитать концентрации, полученные от нее, перед расчетом концентраций видов, полученных в результате последующей ионизации. Этот подход показан в следующем примере.
Ионизация дипротической кислоты
«Карбонированная вода» содержит приемлемо количество растворенного углекислого газа. раствор является кислотным, так как CO2 реагирует с водой, образуя углекислую кислоту, H2CO3. Что такое [H3O+], [HCO3–] и [CO32–] в насыщенном раствор CO2 с первоначальным [H2CO3] = 0.033?
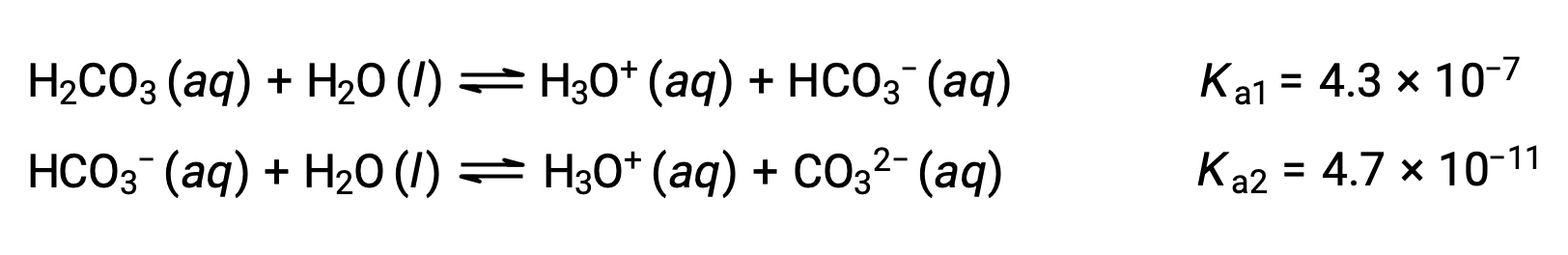
Как указывают константы ионизации, H2CO3 является гораздо более сильной кислотой, чем HCO3, поэтому ступенчатую ионизационную реакцию можно обработать отдельно.используя предоставленную информацию, подготовлена таблица ICE для первого шага ионизации:
| H2CO3 (aq) | H3O+ (aq) | HCO3- (aq) | |
| Начальная концентрация (M) | 0.033 | ~0 | 0 |
| Изменение (M) | x | +x. | +x. |
| Равновесная концентрация (M) | 0.033 – x. | x | x |
Подстановка равновесных концентраций в уравнение равновесия дает
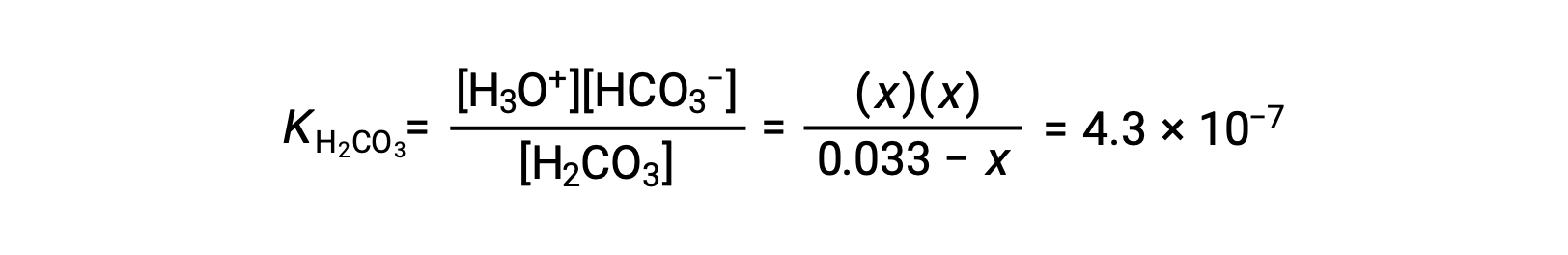
Предположим, что x << 0.033 и решение упрощенного уравнения дает
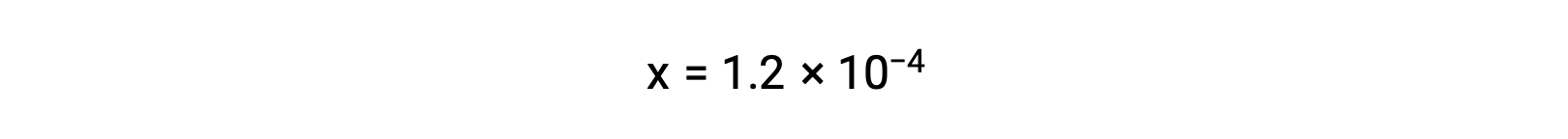
Ледяной стол определил x как равный молярности иона бикарбоната и молярности иона-гидрония:
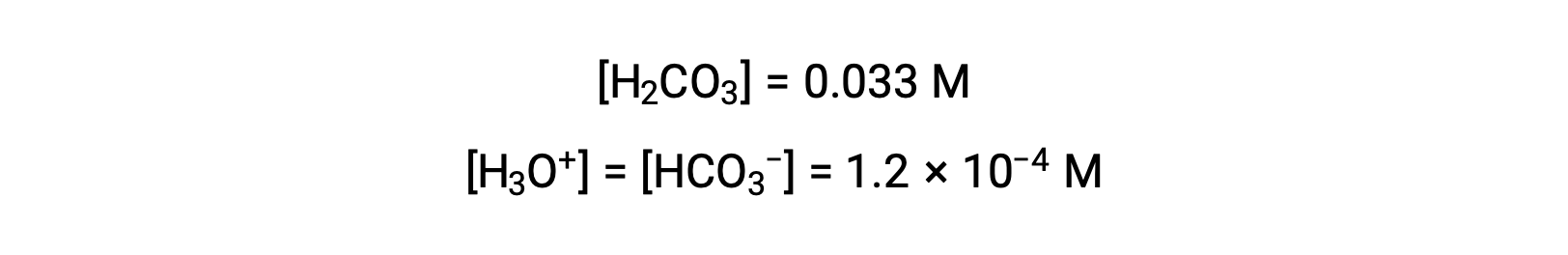
С помощью концентрации ионов бикарбоната, вычисленной выше, вторая ионизация подвергается аналогичному расчету равновесия: HCO3– (aq) + H2O (l) ⇌ H3O+ (aq) + CO32– (aq)
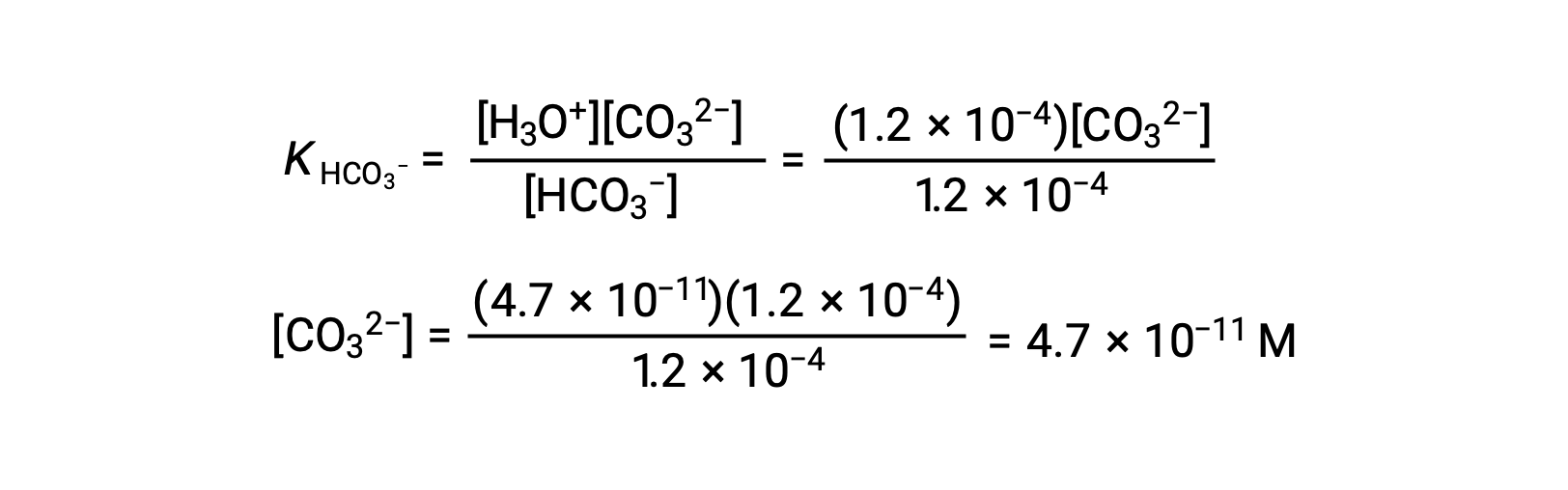
Подведение итогов: При равновесии [H2CO3] = 0.033 м; [H3O+] = 1.2 × 10-4; [HCO3–] = 1.2 × 10-4 м; и [CO32–] = 4.7 × 10-11 М.
Трипростическая кислота — это кислота, имеющая три атома H, которые можно ионизации. Фосфорная кислота является одним из примеров:
| Трипростическая кислота: Фосфорная кислота (H3PO4) | ||
| 1-я ионизация | H3PO4 (aq) + H2O (l) ⇌ H3O+ (aq) + H2PO4– (aq) | KA1 = 7.5 × 10-3 |
| 2-я ионизация | H2PO4– (Aq) + H2O (l) ⇌ H3O+ (Aq) + HPO42– (Aq) | KA2 = 6.2 × 10-8 |
| 3-я ионизация | HPO42– (aq) + H2O (l) ⇌ H3O+ (aq) + PO43– (aq) | Ka3 = 4.2 × 10-13 |
Что касается примеров диметической кислоты, то каждая последовательная реакция ионизации менее обширна, чем первая, что отражается в уменьшении значений для констант ионизации поэтапной кислоты. Это общая характеристика полипроптических кислот и последовательных констант ионизации часто отличаются в коэффициенте от 105 до 106.
Этот набор из трех реакций диссоциации может усложнить расчеты равновесных концентраций в раствор H3PO4. Однако, поскольку последовательные константы ионизации отличаются в коэффициенте от 105 до 106, существуют большие различия в небольших изменениях концентрации, сопровождающих ионизационные реакции. Это позволяет использовать математические предположения и процессы, как показано в примерах выше. Полипротические основания способны принимать более одного иона водорода. Карбонатный ион является примером дипротического основание, поскольку он может принимать два протона, как показано ниже. Как и в случае с полипростическими кислотами, обратите внимание, что константы ионизации уменьшаются с шагом ионизации. Аналогично, расчеты равновесия с использованием полипротических оснований следуют тем же подходам, что и для полипроптических кислот.
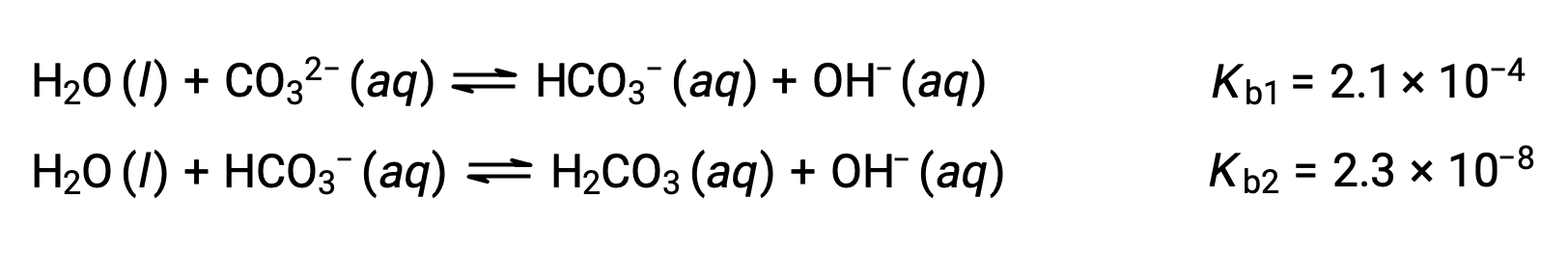
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 14.5: Полибростические кислоты.
