10.9:
Teoria dos Orbitais Moleculares II
16,222 Views
•
•
Diagramas de Energia de Orbitais Moleculares
Os níveis relativos de energia das orbitais atómicas e moleculares são tipicamente mostrados em um diagrama orbital molecular. Para uma molécula diatómica, as orbitais atómicas de um átomo são mostradas à esquerda, e as do outro átomo são mostradas à direita. Cada linha horizontal representa uma orbital que pode conter dois eletrões. As orbitais moleculares formadas pela combinação das orbitais atómicas são mostradas no centro. As linhas tracejadas mostram quais das orbitais atómicas se combinam para formar as orbitais moleculares. Para cada par de orbitais atómicas que se combinam, resultam uma orbital molecular de menor energia (ligação) e uma orbital de maior energia (antiligante).
A distribuição de eletrões nestas orbitais moleculares é feita de acordo com o princípio de aufbau. As orbitais de menor energia enchem primeiro lugar; os eletrões espalham-se pelas orbitais degeneradas antes do emparelhamento, e cada orbital pode conter um máximo de dois eletrões com spins opostos.
Ordem de Ligações
O diagrama orbital molecular preenchido mostra o número de eletrões tanto nas orbitais moleculares de ligação como antiligantes. A contribuição líquida dos eletrões para a força de ligação de uma molécula é identificada através da determinação da ordem de ligação. No modelo das orbitais moleculares, um eletrão contribui para uma interação de ligação se ocupar uma orbital de ligação, e contribui para uma interação antiligante se ocupar uma orbital antiligante. A ordem de ligação é calculada subtraindo os eletrões desestabilizadores (antiligantes) dos eletrões estabilizantes (de ligação). Uma vez que uma ligação é composta por dois eletrões, dividimos por dois para obter a ordem de ligação. A equação para determinar a ordem de ligação é a seguinte:
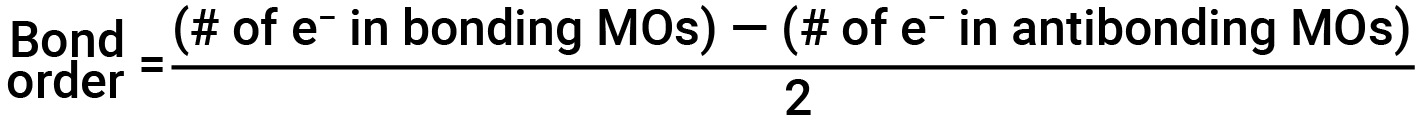
A ordem de ligação é um guia para a força de uma ligação covalente; uma ligação entre dois átomos torna-se mais forte à medida que a ordem de ligação aumenta. Se a distribuição de eletrões nas orbitais moleculares entre dois átomos for tal que a ligação resultante tenha uma ordem de ligação de zero, não se forma uma ligação estável.
Ligações em Moléculas Diatómicas Homonucleares
Uma molécula de hidrogénio (H2) forma-se a partir de dois átomos de hidrogénio. Quando as orbitais atómicas dos dois átomos se combinam, os eletrões ocupam a orbital molecular de menor energia, a orbital de ligação σ1s. Uma molécula de dihidrogénio, H2, é rapidamente formada porque a energia de uma molécula de H2 é menor do que a de dois átomos H. Ambos os eletrões na molécula de H2 estão na orbital de ligação σ1s; a configuração eletrónica é (σ1s)2. Esta configuração é representada por um diagrama de energia orbital molecular, no qual uma única seta para cima indica um eletrão em uma órbita, e duas setas (para cima e para baixo) indicam dois eletrões de spin oposto. Uma molécula de dihidrogénio contém dois eletrões de ligação e nenhum eletrão antiligante, pelo que a ordem de ligação é igual a 1. Assim, a ligação H–H é uma ligação simples.
Um átomo de hélio tem dois eletrões, ambos na sua orbital 1s. Dois átomos de hélio não se combinam para formar uma molécula de dihélio, He2, com quatro eletrões, porque o efeito estabilizador dos dois eletrões na orbital de ligação de energia inferior seria compensado pelo efeito desestabilizador dos dois eletrões na orbital molecular antiligante de energia superior. A configuração eletrónica hipotética de He2 é (σ1s)2(σ*1s)2. A ordem de ligação em uma molécula hipotética de dihélio seria zero. Isto indica que não se forma qualquer ligação entre os dois átomos de hélio.
Ligações em Moléculas Diatómicas Homonucleares do Segundo Período
Podem ser formadas oito moléculas homonucleares diatómicas com os átomos do segundo período da tabela periódica: Li2, Be2, B2, C2, N2, O2, F2, e Ne2. A molécula Be2 e a molécula Ne2 não seriam estáveis devido a ordem de ligação zero.
Para as configurações eletrónicas de orbitais moleculares de valência, os eletrões de valência são atribuídos a orbitais moleculares de valência com as energias mais baixas possíveis. Consistente com a regra de Hund, sempre que houver duas ou mais orbitais moleculares degeneradas, os eletrões preenchem cada orbital desse tipo individualmente antes de ocorrer qualquer emparelhamento de eletrões.
As orbitais σ são geralmente mais estáveis do que as orbitais π. No entanto, nem sempre é esse o caso. Para átomos com três ou menos eletrões nas orbitais p (Li a N), observa-se um padrão diferente, no qual a orbital σp tem mais energia do que o conjunto πp.
Esta alteração na ordem orbital ocorre devido a um fenómeno chamado mistura s–p. A mistura s–p não cria novas orbitais; ela simplesmente influencia as energias das orbitais moleculares existentes. A função de onda σs combina matematicamente com a função de onda σp, resultando em que a orbital σs torna-se mais estável e a orbital σp torna-se menos estável. Da mesma forma, as orbitais antiligantes também são submetidas a mistura s–p, com σs* a tornar-se mais estável e σp* a tornar-se menos estável.
A mistura s–p ocorre quando as orbitais s e p têm energias semelhantes. A diferença de energia entre as orbitais 2s e 2p em O, F, e Ne é maior do que em Li, Be, B, C, e N. Por causa disso, O2, F2, e Ne2 apresentam uma mistura s–p insignificante (insuficiente para alterar a ordem de energia), e os seus diagramas OM seguem o padrão normal, como mostra a figura acima. Todas as outras moléculas diatómicas do período 2 têm mistura s–p, o que leva ao padrão onde a orbital σp é elevado acima do conjunto de πp.
Este texto é adaptado de Openstax, Chemistry 2e, Section 8.4: Molecular Orbital Theory.
