5.2:
기체 법칙
5.2:
기체 법칙
실험을 통해 과학자들은 압력과 온도, 압력 및 부피, 부피 및 온도, 볼륨 및 두더지와 같은 변수 쌍 간의 수학적 관계를 확립하여 이상적인 가스를보유합니다.
압력과 온도: 게이-루삭의 법칙 (아몬튼의 법칙)
압력 게이지에 부착된 단단한 용기를 가스로 채운 다음 가스가 빠져나갈 수 없도록 컨테이너를 밀봉한다고 상상해 보십시오. 용기가 냉각되면 내부의 가스도 마찬가지로 차가워지고 압력이 감소하는 것으로 관찰됩니다. 용기는 단단하고 단단히 밀봉되어 있기 때문에 가스의 부피와 두더지 수는 모두 일정하게 유지됩니다. 구가 가열되면 내부의 가스가 뜨거워지고 압력이 증가합니다.
온도와 압력은 선형적으로 관련되어 있으며, 이러한 관계는 일정한 부피에 국한된 가스 의 모든 샘플에 대해 관찰됩니다. 온도가 켈빈 규모에 있는 경우 P와 T는 직접적으로 비례합니다(가스의 부피와 두더지가 일정하게 유지되는 경우). 켈빈 스케일의 온도가 특정 요인에 의해 증가하면 가스 압력이 동일한 인자에 의해 증가합니다.
가스에 대한 이 압력 온도 관계는 게이-루삭의 법칙으로 알려져 있습니다. 법에 따르면 주어진 양의 가스의 압력은 부피가 일정하게 유지될 때 켈빈 스케일의 온도에 직접적으로 비례한다고 명시되어 있습니다. 수학적으로, 이것은 다음과 같이 기록될 수 있습니다.

여기서 k는 가스의 정체성, 양 및 부피에 따라 비례상수입니다. 가스의 제한된 일정한 부피의 경우, 비율 P/T는 따라서 일정합니다(즉,P/T =k). 가스가 처음에 ‘조건 1′(P = P = P1 및 T = T1)이고‘조건 2’로 변경된 경우(P = P= P2 및 T = T2)다음
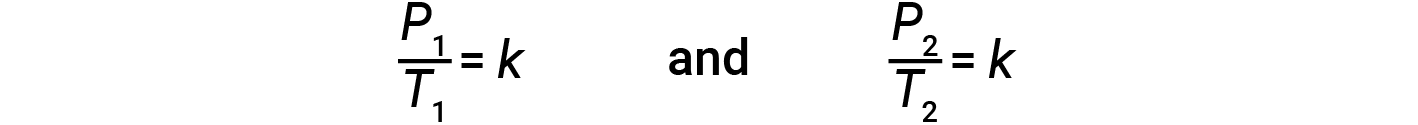
따라서
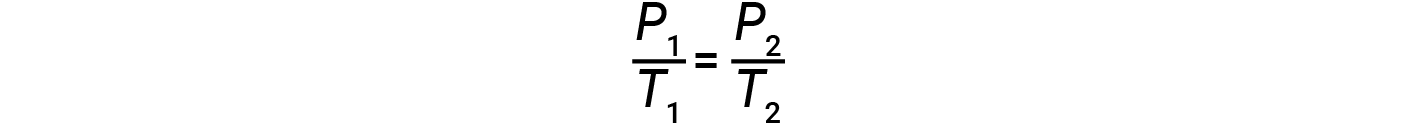
가스 법 계산의 경우 온도가 켈빈 규모에 있어야 합니다.
볼륨 및 온도: 찰스의 법칙
풍선이 공기로 채워지고 밀봉된 경우 풍선에는 대기압(1atm)에서 특정 량의 공기가 포함되어 있습니다. 풍선이 냉장고에 놓이면 내부의 가스가 차가워지고 풍선이 수축됩니다(가스의 양과 압력 모두 일정하게 유지되지만). 풍선이 매우 추워지면 큰 거래가 줄어들 것입니다. 워밍업하면 풍선이 다시 확장됩니다.
이는 일정한 압력에서 제한된 가스의 주어진 양에 온도가 미치는 영향의 예입니다. 온도가 증가함에 따라 부피가 증가하고 온도가 감소함에 따라 부피가 감소합니다.
일정한 압력에서 주어진 양의 가스의 부피와 온도 사이의 관계는 찰스의 법칙으로 알려져 있습니다. 법에 따르면 주어진 양의 가스의 양은 압력이 일정하게 유지될 때 켈빈 스케일의 온도에 직접적으로 비례한다고 명시되어 있습니다.
수학적으로, 이것은 다음과 같이 기록될 수 있습니다.
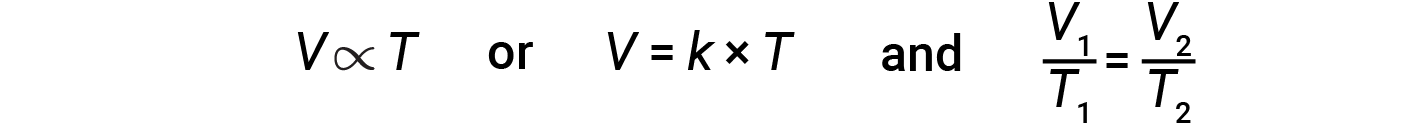
여기서 K는 가스의 양과 압력에 따라 비례상수입니다. 일정한 압력에서 제한된 가스의 경우 비율 V/T는 일정합니다.
볼륨과 압력: 보일의 법칙
밀폐 된 주사기가 부분적으로 공기로 채워진 경우 주사기에는 일정한 온도에서 특정 양의 공기가 포함되어 있습니다. 온도가 일정하게 유지되는 동안 플런저를 천천히 누르면 주사기의 가스가 더 작은 부피로 압축되고 압력이 증가합니다. 플런저를 추출하면 가스의 부피가 증가하고 압력이 감소합니다.
포함된 가스의 부피를 줄이면 압력이 증가하고 부피가 증가하면 압력이 감소합니다. 볼륨이 특정 요인에 의해 증가하면 압력이 동일한 요인에 의해 감소하고 그 반대의 경우도 마찬가지입니다. 따라서 압력 및 부피는 역비례를 나타낸다: 비례성: 압력을 증가하면 가스의 부피가 감소합니다. 수학적으로 이 것을 기록할 수 있습니다.
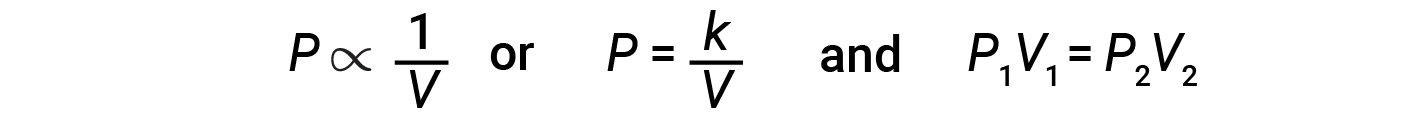
K가 상수인 곳. P 대 V플롯에는 과볼라가 표시됩니다. 곡선선이 있는 그래프는 변수의 낮거나 높은 값으로 정확하게 읽기 가 어렵고 이론 방정식 및 매개 변수를 실험 데이터에 맞추는 데 사용하기가 더 어렵습니다. 이러한 이유로 과학자들은 종종 데이터를 “선형화”할 방법을 찾으려고 노력합니다. 그래픽적으로 압력과 볼륨 간의 관계는 압력과 볼륨의 반전, 또는 압력 대 볼륨의 반전을 플로팅하여 표시됩니다.
일정한 온도에서 주어진 양의 가스의 부피와 압력 사이의 관계는 보일의 법칙에 의해 주어진다: 일정한 온도에서 보유 가스의 주어진 양의 부피는 측정되는 압력에 반비례한다.
가스 및 볼륨의 두더지: 아보가드로의 법칙
이탈리아 과학자 Amedeo Avogadro는 1811년에 가설을 진행하여 가스의 행동을 고려하여 동일한 수의 온도 및 압력 조건에서 측정된 모든 가스의 동일한 양이 동일한 분자수를 함유하고 있다고 밝혔습니다. 시간이 지남에 따라, 이 관계는 Avogadro의 법에 의해 표현된 많은 실험 관측에 의해 지원되었다: 밀폐 된 가스의 경우, 볼륨 (V) 및 두더지의 수는 압력과 온도가 모두 일정하게 유지되는 경우 직접 비례.
방정식 양식에서 이 글은 다음과 같이 기록됩니다.
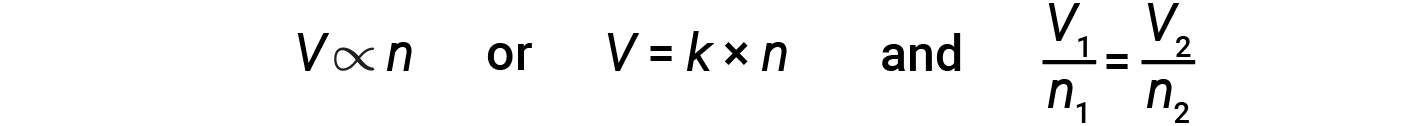
수학 관계는 P 대 n및 N 대 T와같은 다른 변수 쌍에 대해 서도 결정할 수 있습니다.
이상적인 가스 법
이 네 가지 법률을 결합하면 이상적인 가스 법, 압력, 부피, 온도 및 가스의 두더지 수 사이의 관계가 생성됩니다.
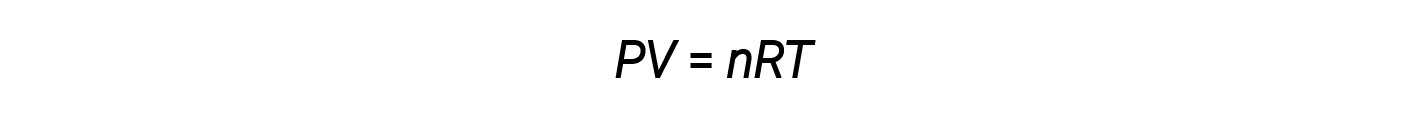
여기서 R은 이상적인 가스 상수 또는 범용 가스 상수라고 하는 상수이다. 압력, 부피 및 온도를 표현하는 데 사용되는 장치는 치수 해석에 필요한 가스 상수의 적절한 형태를 결정합니다. R의 가장 일반적으로 발생 값은 0.08206 L⋅atm mol-1⋅K-1 및 8.314 kPa⋅L mol-1⋅K–1입니다.
P, V및 T의 특성이 이상적인 가스 법(또는 다른 가스 법)에 의해 정확하게 설명되는 가스는 이상적인 행동을 나타내거나 이상적인 가스의 특성을 근사화하는 것으로 전합니다. 이상적인 가스는 상대적으로 낮은 압력과 고온의 조건에서 가스에 대해서만 합리적인 가상의 구조입니다.
이상적인 가스 방정식에는 5개의 용어, 가스 상수 R 및 가변 속성 P, V, n및 T가 포함되어 있습니다. 이 약관의 네 가지를 지정하면 이상적인 가스법을 사용하여 다섯 번째 기간을 계산할 수 있습니다.
이상적인 가스의 두더지 수가 두 가지 조건 집합에 따라 일정하게 유지되는 경우, 결합된 가스법(atm, L 및 K 단위 사용)이라는 유용한 수학적 관계가 얻어진다.
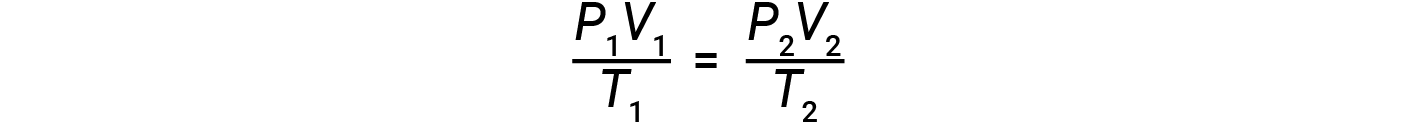
조건의 두 세트는 n × R의 제품과 동일합니다 (여기서 n = 가스 및 R의 두더지 의 수는 이상적인 가스 법 상수입니다).
이 텍스트는 Openstax, 화학 2e, 섹션 9.2: 압력, 볼륨, 양 및 온도 관련: 이상적인 가스 법에서채택 됩니다.
