14.10:
A Aproximação do x Pequeno
42,866 Views
•
•
Se uma reação tiver uma constante de equilíbrio pequena, a posição de equilíbrio favorece os reagentes. Em tais reações, pode ocorrer uma alteração negligenciável da concentração se as concentrações iniciais de reagentes forem elevadas e o valor de Kc for pequeno. Nessas circunstâncias, a concentração de equilíbrio é aproximadamente igual à sua concentração inicial. Esta estimativa pode ser utilizada para simplificar os cálculos de equilíbrio, partindo do princípio de que algumas concentrações de equilíbrio são iguais às concentrações iniciais. No entanto, para fazer esta suposição, a variação da concentração de ácido ou base fraco, ou seja, x, deve ser inferior a 5% da sua concentração inicial. Se x for superior a 5%, então a fórmula quadrática precisa ser usada para resolver a equação de equilíbrio.
Cálculo das Concentrações de Equilíbrio Utilizando uma Suposição para Simplificação da Álgebra
Quais são as concentrações em equilíbrio de uma solução de 0,15 M de HCN?
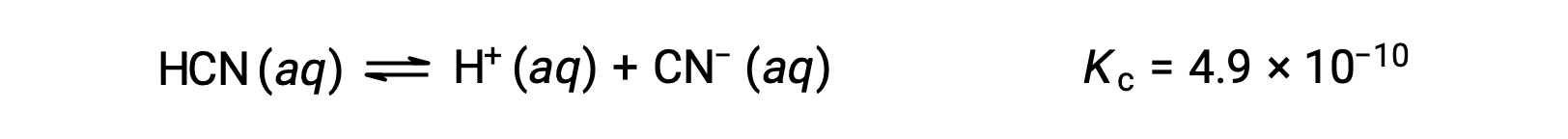
Usando x para representar a concentração de cada produto em equilíbrio obtemos esta tabela ICE.
| HCN (aq) | H+ (aq) | CN− (aq) | |
| Concentração Inicial (M) | 0,15 | 0 | 0 |
| Alteração (M) | −x | +x | +x |
| Concentração em Equilíbrio (M) | 0,15 − x | x | x |
Substituindo os termos de concentração de equilíbrio na expressão de Kc
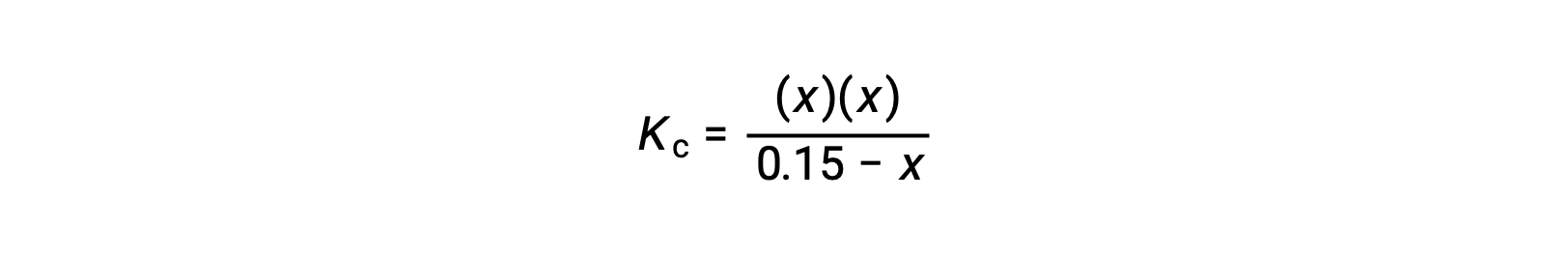
reorganizando para a forma quadrática e resolvendo para x
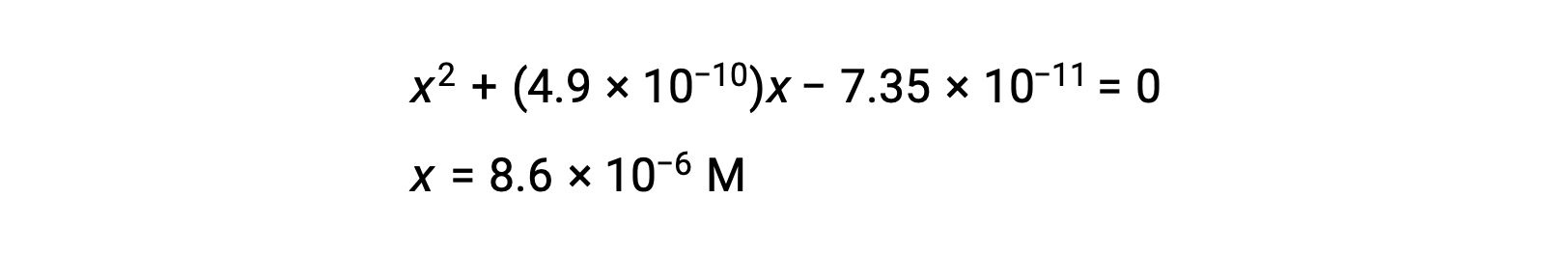
Assim, [H+] = [CN–] = x = 8,6 × 10–6 M e [HCN] = 0,15 – x = 0,15 M.
Note, neste caso, que a alteração da concentração é significativamente inferior à concentração inicial (consequência do K pequeno), pelo que a concentração inicial sofre uma alteração negligenciável:

Essa aproximação permite uma abordagem matemática mais rápida para o cálculo que evita a necessidade de resolver para as raízes de uma equação quadrática:
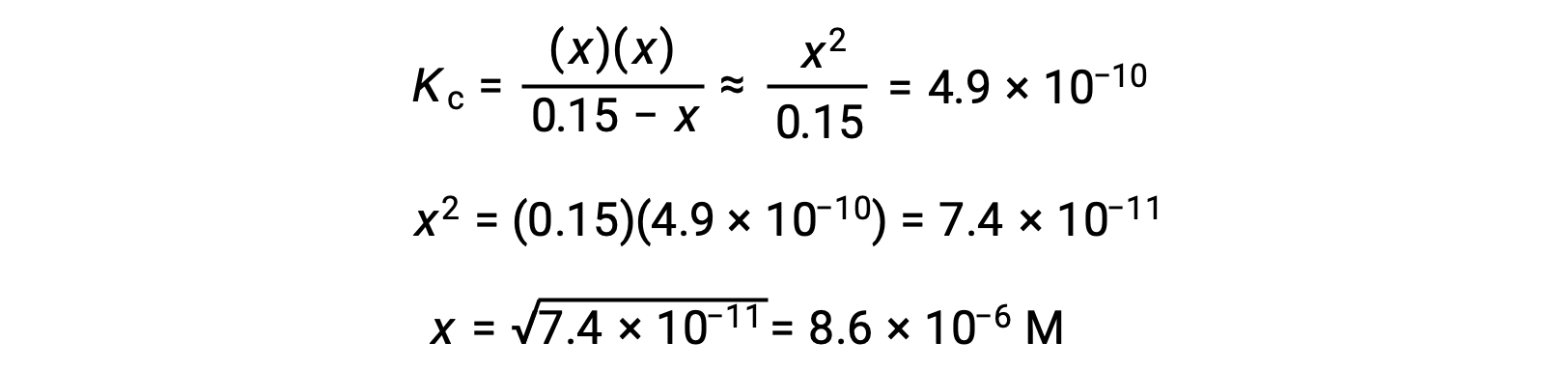
O valor de x calculado é, de facto, muito inferior à concentração inicial
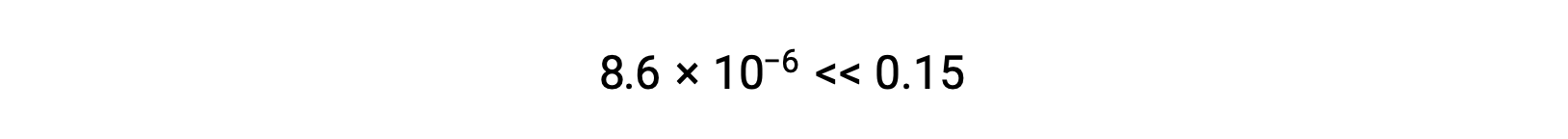
e portanto a aproximação foi justificada. Se esta abordagem simplificada produzisse um valor para x que não justificasse a aproximação, o cálculo teria de ser repetido sem fazer a aproximação.
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
