16.10:
Equilíbrio de Solubilidade
43,739 Views
•
•
Os equilíbrios de solubilidade são estabelecidos quando a dissolução e precipitação de uma espécie de soluto ocorrem a velocidades iguais. Estes equilíbrios estão na base de muitos processos naturais e tecnológicos, que vão desde a degradação dos dentes até à purificação da água. A compreensão dos factores que afetam a solubilidade de compostos é, portanto, essencial para a gestão eficaz desses processos. Esta secção aplica conceitos e ferramentas de equilíbrio previamente introduzidos aos sistemas que envolvem dissolução e precipitação.
O Produto da Solubilidade
Recorde que a solubilidade de uma substância pode variar de praticamente zero (insolúvel ou pouco solúvel) a infinito (miscível). Um soluto com solubilidade finita pode produzir uma solução saturada quando adicionada a um solvente em quantidade superior à sua solubilidade, resultando em uma mistura heterogénea da solução saturada e no excesso de soluto não dissolvido. Por exemplo, uma solução saturada de cloreto de prata é aquela em que o equilíbrio mostrado abaixo foi estabelecido.
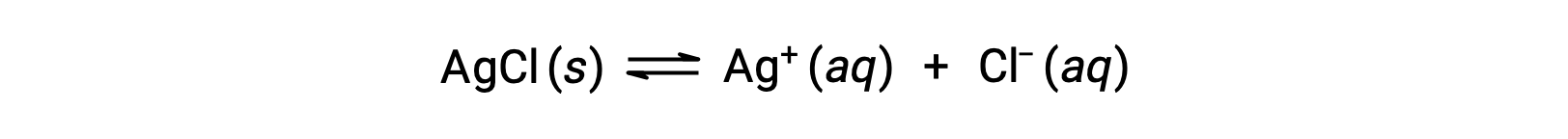
Nesta solução, um excesso de AgCl sólido dissolve e dissocia-se para produzir iões aquosos Ag+ e Cl– à mesma velocidade que estes iões aquosos se combinam e precipitam para formar AgCl sólido. Como o cloreto de prata é um sal moderadamente solúvel, a concentração de equilíbrio dos iões dissolvidos na solução é relativamente baixa.
A constante de equilíbrio para os equilíbrios de solubilidade, como esta, é chamada de constante do produto de solubilidade, Ksp, neste caso
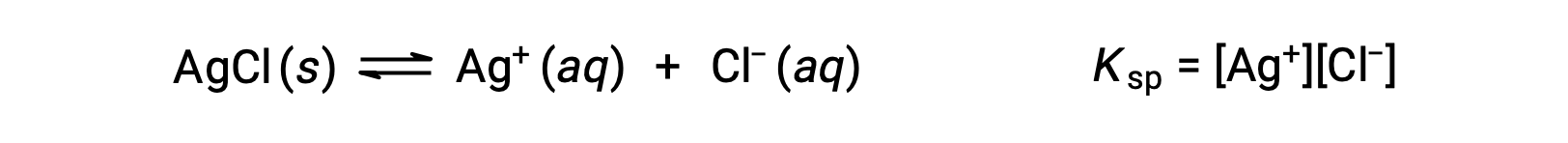
Recorde que somente gases e solutos são representados em expressões de constantes de equilíbrio, de modo que Ksp não inclui um termo para o AgCl não dissolvido.
Ksp e Solubilidade
O Ksp de um composto iónico ligeiramente solúvel pode estar simplesmente relacionado com a sua solubilidade medida, desde que o processo de dissolução envolva apenas dissociação e solvatação, por exemplo:
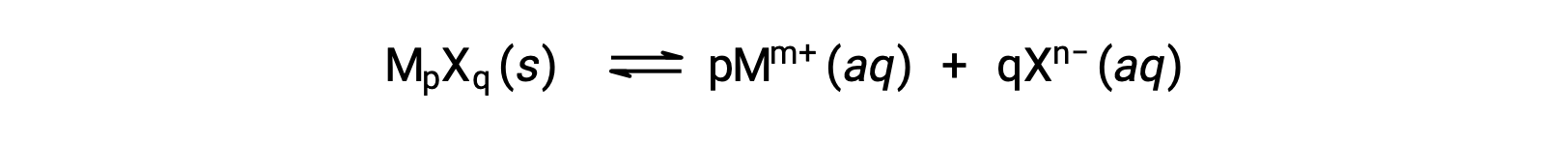
Para casos como estes, pode-se derivar valores de Ksp das solubilidades fornecidas, ou vice-versa. Os cálculos deste tipo são mais convenientemente realizados utilizando a solubilidade molar de um composto, medida como moles de soluto dissolvido por litro de solução saturada.
Previsão da Precipitação
A equação que descreve o equilíbrio entre carbonato de cálcio sólido e os seus iões solvatados é:
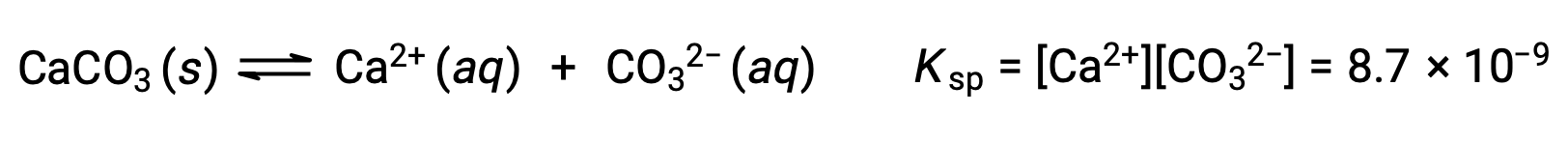
É importante perceber que este equilíbrio é estabelecido em qualquer solução aquosa contendo iões Ca2+ e CO32–, não apenas em uma solução formada por água saturada com carbonato de cálcio. Considere, por exemplo, a mistura de soluções aquosas dos compostos solúveis carbonato de sódio e nitrato de cálcio. Se as concentrações de iões de cálcio e carbonato na mistura não produzirem um quociente de reação, Q, que exceda o produto de solubilidade, Ksp, então não ocorrerá precipitação. Se as concentrações de iões produzirem um quociente de reação superior ao produto de solubilidade, então ocorrerá precipitação, diminuindo essas concentrações até que seja estabelecido o equilíbrio (Q = Ksp). A comparação de Q com Ksp para prever a precipitação é um exemplo da abordagem geral para prever a direção de uma reação introduzida pela primeira vez nas aulas sobre o equilíbrio. Para o caso específico dos equilíbrios de solubilidade:
Q < Ksp: A reação prossegue na direção direta (a solução não está saturada; não foi observada precipitação)
Q > Ksp: A reação prossegue na direção inversa (a solução está supersaturada; ocorrerá precipitação)
Este texto é adaptado de Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
