18.7:
농도차 전지
Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
JoVE Central
Quimica
Concentration Cells
18,973 Views
•
02:41 min
•
September 24, 2020
농도 세포는 동일한 반반응에 기초하여 동일한 전극을 사용하여 두 개의 거의 동일한 반세포를 연결하고 동일한 전극을 사용하여 생성된 볼타이크 세포의 유형으로, 하나의 레독스 종의 농도에서만 다릅니다. 농도 세포의 잠재력, 따라서, 특정 레독스 종의 농도 차이에 의해서만 결정된다.
다음 광능 셀을 고려하십시오.
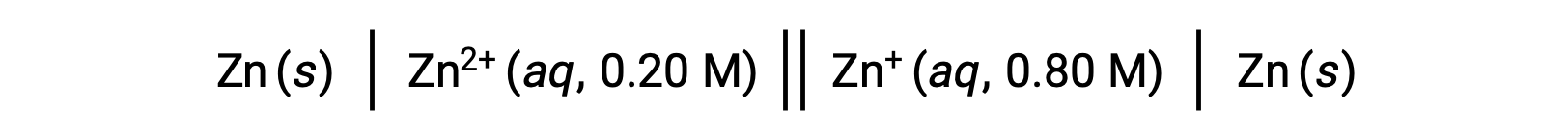
주어진 정보에서, 이 농도 세포의 세포 전위는 Nernst 방정식을 사용하여 계산될 수 있습니다:

Nernst 방정식으로 대체,
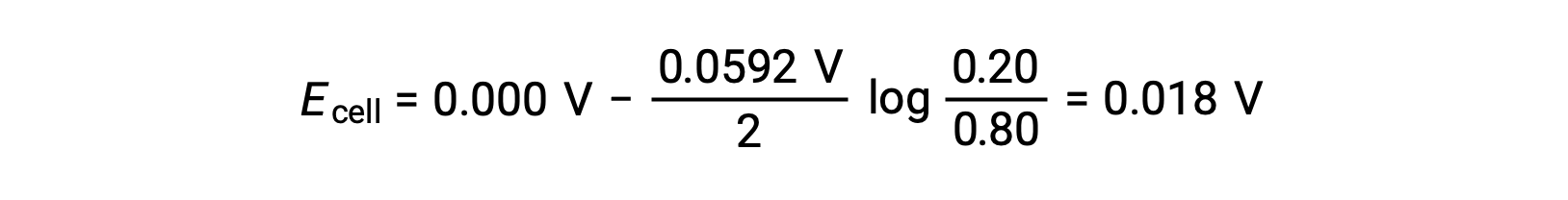
세포 전위력의 양수 값은 전반적인 세포 반응이 자발적임을 나타냅니다. 이러한 자발적반응은 양극에서 아연 이온 농도가 떨어질 때 발생하며(정소 아연으로 의 감소)는 양극에서 상승(아연 양극의 산화에 의해 아연 이온)이 발생합니다. 아연의 감소를 위한 더 큰 원동력은 음극에 존재하며, Zn2+ 이온 농도가 더 큽니다(E음극 > E양극).
실험실에서 pH 미터, 신경 세포막내의 이온 채널, 인체의 심장 근육 세포는 농도 세포의 원리에 작용한다.
Tags
Concentration CellsCell PotentialRedox ReactionReactantsProductsNickel-silver Galvanic CellStandard ConditionsConcentration GradientElectrochemical CellHalf-reactionsSilver ElectrodesSilver IonsOxidationReductionLe Châtelier’s PrincipleElectron FlowDilute CellConcentrated CellNernst EquationEquilibriumPH Meters
