4.3:
반응 수율
39,303 Views
•
•
반응의 이론적 수율은 균형 잡힌 화학 방정식의 stoichiometry에 기초하여 형성될 것으로 추정되는 제품의 양이다. 이론적 수율은 제한 반응제를 원하는 제품으로 완전히 변환한다고 가정합니다. 반응을 수행함으로써 얻어지는 제품의 양은 실제 수율이라고 하며, 이론적 수율과 동일하거나(매우 드물게) 적을 수 있다.
백분율 수익률
화학 반응의 경우, 제품의 실제 수율은 종종 반응의 stoichiometry에 따라 예측 된 이론적 수율보다 적습니다. 주어진 조건하에서 반응이 수행되면 여러 가지 이유로 인해 질량손실이 불가피할 것으로 예상됩니다. 일부 반응은 자연적으로 비효율적이며 측면 반응을 통해 다른 바람직하지 않은 제품을 생성합니다. 다른 사람은 그들의 가역적인 성격 때문에 불완전합니다, 반응제와 제품 사이 평형의 상태를 동반합니다. 때로는 제품 질량의 손실은 결정화, 증류, 여과 및 크로마토그래피와 같은 정제 기술 동안 반응 혼합물로부터 원하는 제품의 부적절한 회복에 기인한다. 제품 손실이 발생하는 경우 백분율 수율이 반응의 이론적 수율이 달성되는 정도를 측정하는 데 사용됩니다.

실제 및 이론적 수율은 질량 또는 어금량(또는 제품이 가스인 경우 부피 와 같은 기타 적절한 특성)으로 표현될 수 있습니다. 두 수율이 동일한 단위로 표현되는 한 백분율 수율이 계산되면 이 단위가 취소됩니다.
백분율 수율 계산
산화 질소를 이산화질소로 연소하는 것을 고려하십시오.
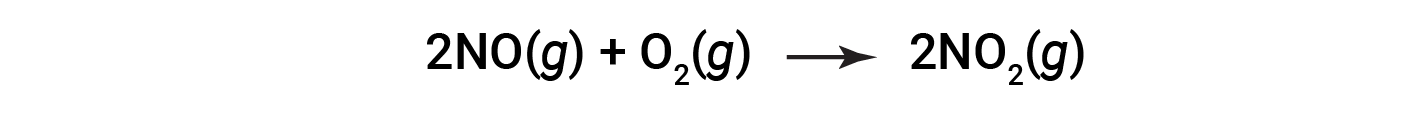
반응의 끝에서, 180 그램의 이산화질소는 산화 질소의 150 그램및 산소의 과잉에서 얻어진다. 백분율 수익률은 무엇입니까?
반응의 실제 수율은 180 그램입니다. 산화 질소가 제한 반응제임을 알고, 이론적 수율의 두더지는 NO 및 NO2의stoichiometry에 따라 얻어진다. 첫째, NO의 질량은 NO의 두더지로 변환됩니다. 이어서 NO:NO 2(1:1)의 금식비율이 적용되며, 이는 NO2의 두더지가 NO의 5두더지에서 형성될 것임을 시사한다. 셋째, NO2의 두더지가 질량으로 변환됩니다.

마지막 단계에서 백분율 수율은 실제 수율에서 이론수율에 대한 비율을 기준으로 계산됩니다.

