10.1:
Свойства переходных металлов
20,551 Views
•
•
Переходные металлы определяются как элементы, частично заполненные d orbitals. Как показано на рис. 1, элементы d-блока в группах 3–12 являются переходными элементами. Элементы f-блока, также называемые внутренними переходными металлами (лантаноиды и актиниды), также отвечают этому критерию, поскольку d орбитальная часть частично занята перед ф орбиталами.
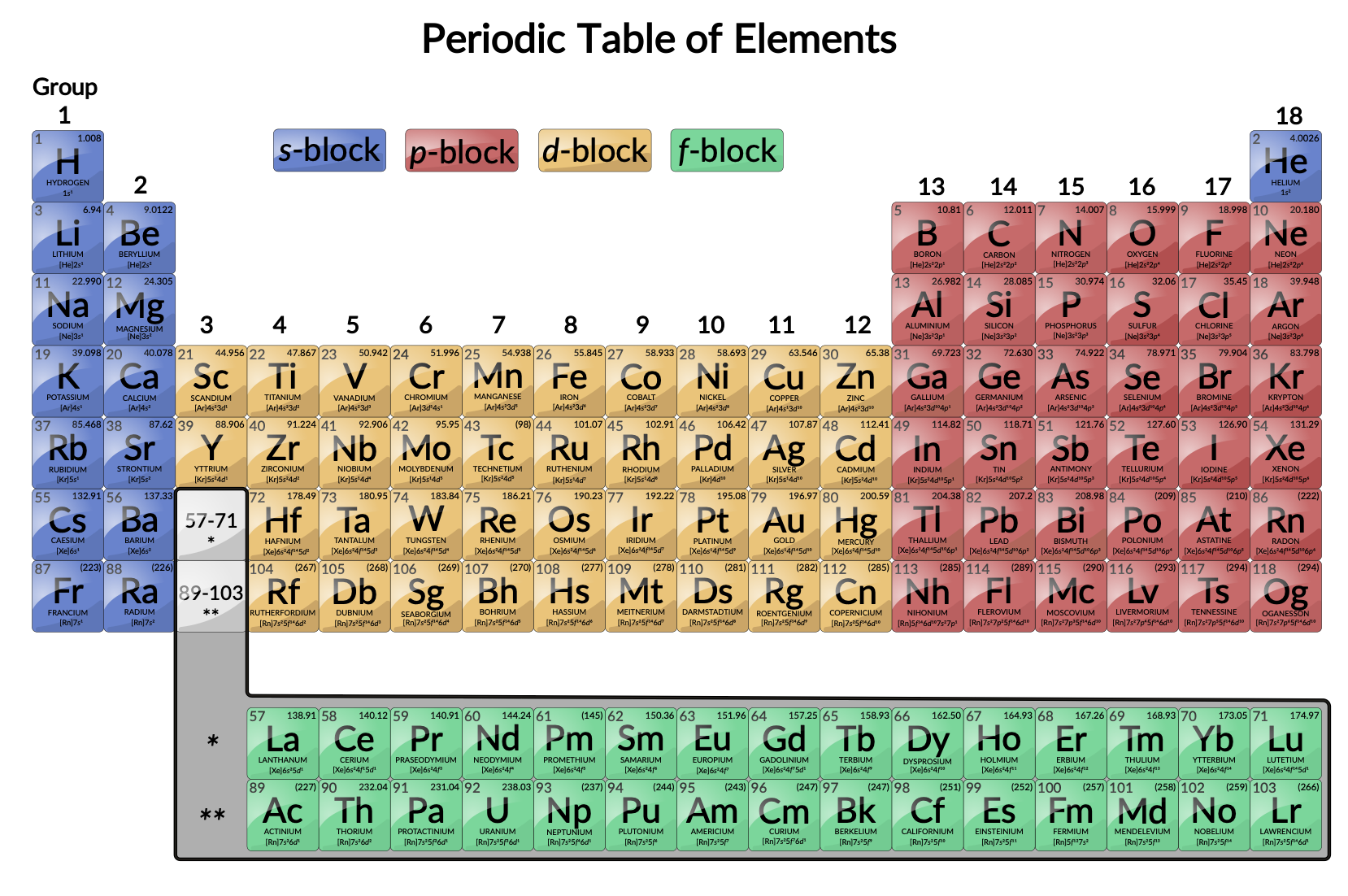
Рисунок 1: Периодическая таблица. Переходные металлы расположены в группах 3–11 периодической таблицы. Внутренние переходные металлы находятся в двух рядах под телом таблицы.
Элементы d-блока разделены на первую переходную серию (элементы SC – Cu), вторую переходную серию (элементы Y – AG) и третью переходную серию (элемент La и элементы HF – Au). Actinium, AC, является первым участником четвертой переходной серии, которая также включает RF через RG.
Элементы f-блока — это элементы CE – Lu, которые составляют серию лантаноидов (или серию лантаноидов), и элементы TH – LR, которые составляют серию актинидов (или серию актиноидов). Поскольку лантан ведет себя очень подобно элементам лантанода, он считается лантаноидным элементом, даже если его электронная конфигурация делает его первым членом третьей переходной серии. Аналогично, поведение актиния означает, что он является частью серии actinide, хотя его электронная конфигурация делает его первым членом четвертой переходной серии.
Переходные элементы имеют много свойств, общих с другими металлами. Они почти все твердые, высокоплавильные твердые вещества, которые хорошо проводят тепло и электричество. Они легко образуют сплавы и теряют электроны, образуя стабильные катиации. Кроме того, переходные металлы образуют широкий спектр стабильных координационных соединений, в которых центральный атом металла или ион действует как кислота Льюиса и принимает одну или несколько пар электронов. Многие различные молекулы и ионы могут пожертвовать одиночные пары в металлический центр, выступая в роли баз Льюиса.
Свойства элементов перехода
Переходные металлы демонстрируют широкий спектр химического поведения. Некоторые переходные металлы являются сильными восстановителями, в то время как другие имеют очень низкую реактивность. Например, все лантаноиды образуют стабильные 3+ водянистой каций. Движущая сила таких окислений аналогична силе щелочных металлов, таких как Be или Mg, образующих B2+ и Mg2+. С другой стороны, такие материалы, как платина и золото, обладают гораздо более высокими потенциалами сокращения. Их способность противостоять окислению делает их полезными материалами для построения цепей и ювелирных изделий.
Ионы более легких элементов d-блока, таких как Cr3+, Fe3+ и CO2+, образуют цветные гидрированные ионы, которые устойчивы в воде. Тем не менее, ионы в период ниже этих (Mo3+, RU3+ и IR2+) нестабильны и легко реагируют с кислородом из воздуха. Большинство простых, устойчивых к воде ионов, образованных более тяжелыми элементами d-блока, являются оксяниями, такими как MoO42– и ReO4–.
Рутений, осмия, родий, иридий, палладий, а платина — платиновые металлы. С трудом они образуют простые катионы, которые устойчивы в воде, и, в отличие от более ранних элементов во второй и третьей переходных сериях, они не образуют стабильных оксанионов.
Элементы d– и f-блока реагируют с неметаллами, образуя бинарные соединения; часто требуется нагрев. Эти элементы вступают в реакцию с галогенами, образуя различные галоиды в окислительной форме от +1 до +6. При нагревании кислород реагирует со всеми переходными элементами, за исключением палладия, платины, серебра и золота. Оксиды этих последних металлов могут образовываться с помощью другого реагенты, но они разлагаются при нагревании. Элементы f-блока, элементы группы 3, и элементы первой переходной серии, кроме меди, вступают в реакцию с водными растворами кислот, образуя водород и растворы соответствующих солей.
Переходные металлы могут образовывать соединения с широким спектром окислительных состояний. Некоторые наблюдаемые состояния окисления элементов первой переходной серии приведены в таблице 1. При перемещении слева направо по первой переходной серии количество общих состояний окисления сначала увеличивается до максимума в сторону середины таблицы, а затем уменьшается. Значения в таблице являются типичными значениями; есть и другие известные значения, и можно синтезировать новые дополнения. Например, в 2014 году исследователи успешно синтезируют новое окислительное состояние иридия (+9).
| 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn |
| +1 | |||||||||
| +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | ||
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |
| +4 | +4 | +4 | +4 | ||||||
| +5 | |||||||||
| +6 | +6 | +6 | |||||||
| +7 |
Таблица 1. Переходные металлы первой переходной серии могут образовывать соединения с различными состояниями окисления.
Для элементов просканируют марганец (первая половина первой переходной серии), наивысшее окислительное состояние соответствует потере всех электронов как в s, так и d орбиталях их валентные оболочки. Титановый ион (IV), например, образуется, когда атом титана теряет два трехмерных и два 4-х электронов. Эти самые высокие состояния окисления являются наиболее стабильными формами скандия, титана и ванадия. Тем не менее, невозможно продолжить удаление всех электронов валентности из металлов по мере продолжения серии. Известно, что железо образует окислительные состояния от +2 до +6, при этом железо(II) и железо(III) являются наиболее распространенными. Большинство элементов первой переходной серии образуют ионы с зарядом 2+ или 3+, которые стабильны в воде, хотя те из ранних членов серии могут быть легко окислены воздухом.
Элементы второй и третьей переходных серий обычно более стабильны в более высоких окислительных состояниях, чем элементы первой серии. В целом, атомный радиус увеличивается вниз по группе, что приводит к тому, что ионы второй и третьей серий превышают ионы первой серии. Удаление электронов с орбитального ядра, расположенного дальше от ядра, проще, чем удаление электронов рядом с ядром. Например, молибден и вольфрам, члены группы 6, в основном ограничены состоянием окисления +6 в водном раствор. Хром, самый легкий член группы, образует стабильные ионы Cr3+ в воде и, в отсутствие воздуха, менее стабильные ионы CR2+. Сульфид с самым высоким состоянием окисления для хрома — Cr2S3, содержащий ион Cr3+. Молибден и вольфрам образуют сульфиды, в которых металлы имеют окислительные состояния +4 и +6.
Разнообразие свойств, представленных переходными металлами, обусловлено их комплексным валентные оболочки. В отличие от большинства металлов основной группы, где обычно наблюдается одно окислительное состояние, структура оболочки валентности переходных металлов означает, что они обычно происходят в нескольких различных стабильных окислительных состояниях. Кроме того, электронные переходы в этих элементах могут соответствовать поглощению фотонов в видимом электромагнитном спектре, что приводит к цветным соединениям. Из-за такого поведения переходные металлы демонстрируют богатую и увлекательную химию.
Этот текст адаптирован к Openstax , Chemistry 2e, Chapter 19.1 Происшествие, подготовка и свойства переходных металлов и их соединений.
