16.13:
Precipitación Iónica
24,987 Views
•
•
Prediciendo la precipitación
La ecuación que describe el equilibrio entre el carbonato de calcio sólido y sus iones solvatados es:
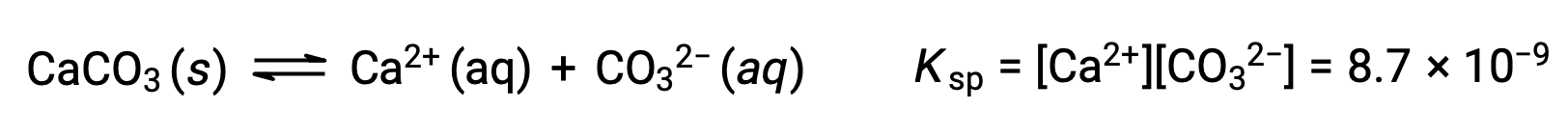
Es importante darse cuenta de que este equilibrio se establece en cualquier solución acuosa que contenga iones Ca2+ y CO32−, no sólo en una solución formada por agua saturada con carbonato de calcio. Consideremos, por ejemplo, mezclar soluciones acuosas de los compuestos solubles carbonato de sodio y nitrato de calcio. Si las concentraciones de iones de calcio y carbonato en la mezcla no producen un cociente de reacción, Q, que excede el producto de solubilidad, Ksp, entonces no se producirá precipitación. Si las concentraciones de iones producen un cociente de reacción mayor que el producto de solubilidad, entonces se producirá precipitación, reduciendo esas concentraciones hasta que se establezca el equilibrio (Q = Ksp). La comparación de Q conKsp para predecir la precipitación es un ejemplo del enfoque general para predecir la dirección de una reacción. Para el caso específico de los equilibrios de solubilidad:
Q < Ksp: La reacción procede en la dirección de avance (solución no saturada; no se observa precipitación)
Q > Ksp: La reacción avanza en dirección inversa (la solución se ha saturado; se producirá precipitación)
En soluciones que contienen dos o más iones que pueden formar compuestos insolubles con el mismo contraion, se puede utilizar una estrategia experimental llamada precipitación selectiva para eliminar iones individuales de la solución. Al aumentar la concentración de contraiones de forma controlada, los iones en solución pueden precipitar individualmente, suponiendo que sus solubilidades compuestas son adecuadamente diferentes. En soluciones con iguales concentraciones de iones diana, el ion que forma el compuesto menos soluble precipitará primero (a la concentración más baja del contraión). Los otros iones se precipitan posteriormente a medida que se alcanzan las solubilidades de su compuesto.
Precipitación de haluros de plata
Una solución contiene 0,00010 mol de KBr y 0,10 mol de KCl por litro. Se añade AgNO3 a esta solución. ¿Qué se forma primero, AgBr sólido o AgCl sólido?
Los dos equilibrios implicados son:
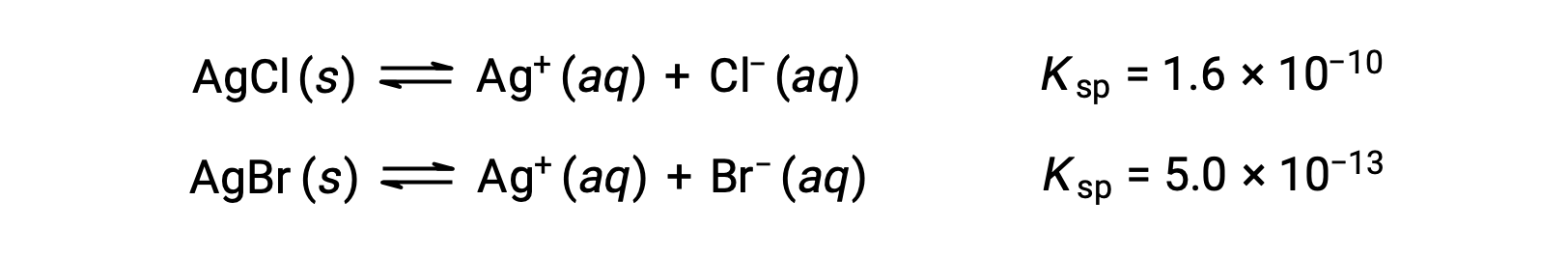
Si la solución contenía unas concentraciones iguales de Cl− y Br, entonces la sal de plata con el Ksp más pequeño (AgBr) precipitaría primero. Sin embargo, las concentraciones no son iguales, por lo que se debe calcular la [Ag+] a la cual el AgBr empieza a precipitar debe ser calculada. La sal que se forma a la [Ag+] más baja, precipita primero.
AgBr precipita cuando Q = Ksp para AgBr
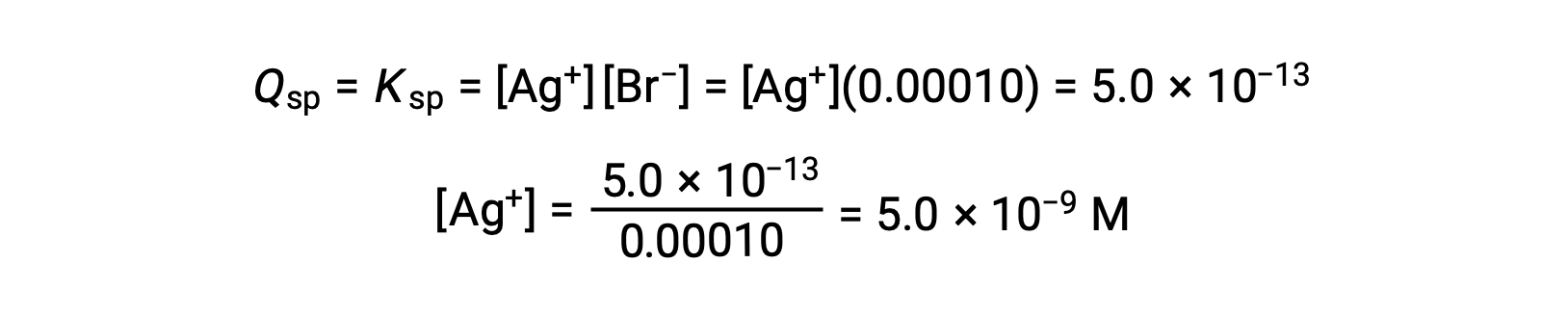
El AgBr comienza a precipitar cuando [Ag+] es de 5,0 × 10−9 M.
Para AgCl:
AgCl precipita cuando Q es igual a Ksp para AgCl (1,6 × 10−10). Cuando [Cl−] = 0,10 M:
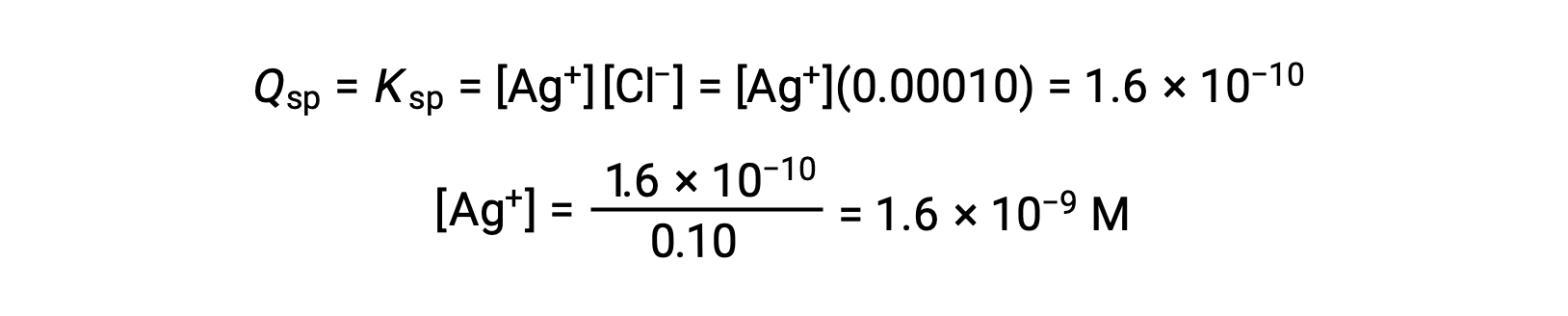
El AgCl comienza a precipitar cuando [Ag+] es de 1,6 × 10−9 M.
El AgCl comienza a precipitar a una [Ag+] más baja que el AgBr, por lo que el AgCl comienza a precipitar primero. Note que la concentración de iones cloruro de la mezcla inicial fue significativamente mayor que la concentración de iones bromuro, por lo que el cloruro de plata precipitó primero a pesar de tener un Ksp mayor que el de bromuro de plata.
Este texto está adaptado de Openstax, Química 2e, Capítulo 15.1: Precipitación y disolución.
