16.13:
Осаждение ионов
24,987 Views
•
•
Прогнозирование осадков
Уравнение, описывающее равновесие между твердым карбонатом кальция и его сольватыми ионами, состоит в следующем:
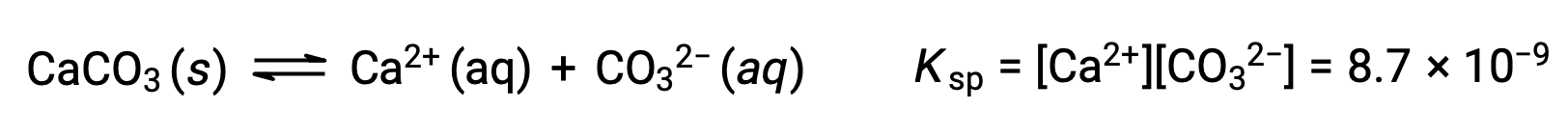
Важно понимать, что это равновесие установлено в любых водных ионах раствор, содержащих ионы Ca2+ и CO32, а не только в раствор, образованной насыщающей водой с карбонатом кальция. Рассмотрим, например, смешивание водных растворов растворимых соединений карбоната натрия и нитрата кальция. Если концентрации ионов кальция и карбоната в смеси не дают реактивного соотита, Q, который превышает продукт растворимости, KSP, то осадки не будут происходить. Если концентрация ионов превышает показатель растворимости, то осадки будут происходить, понижая эти концентрации до тех пор, пока не будет установлено равновесие (Q = KSP). Сравнение Q с KSP для прогнозирования осадков является примером общего подхода к предсказанию направления реакции. Для конкретного случая равновесия растворимости:
Q < KSP: Реакция идет в прямом направлении (раствор не насыщен; осадки не наблюдаются)
Q > KSP: Реакция идет в обратном направлении (раствор перенасыщен; выпадение осадков происходит)
В растворах, содержащих два или более ионов, которые могут образовывать нерастворимые соединения с одним и тем же контрионом, для удаления отдельных ионов из раствор может использоваться экспериментальная стратегия, называемая селективными осадками. Благодаря контролируемому увеличению концентрации контрионов ионы в раствор могут быть осаждены по отдельности, при условии, что их растворимость в смеси будет достаточно разной. В растворах с одинаковой концентрацией целевых ионов ион, образующий наименьшее растворимое соединение, будет осадок первым (при самой низкой концентрации контриона). Другие ионы впоследствии осаждаются по мере достижения растворимости их соединения.
Осадки серебряных галогенидов
раствор содержит 0.00010 моль KBR и 0.10 моль KCl на литр. AgNО3 постепенно добавляется к этому раствор. Какие формы образуют сначала твердое вещество AgBr или твердое вещество AgCl?
Два равновесия:
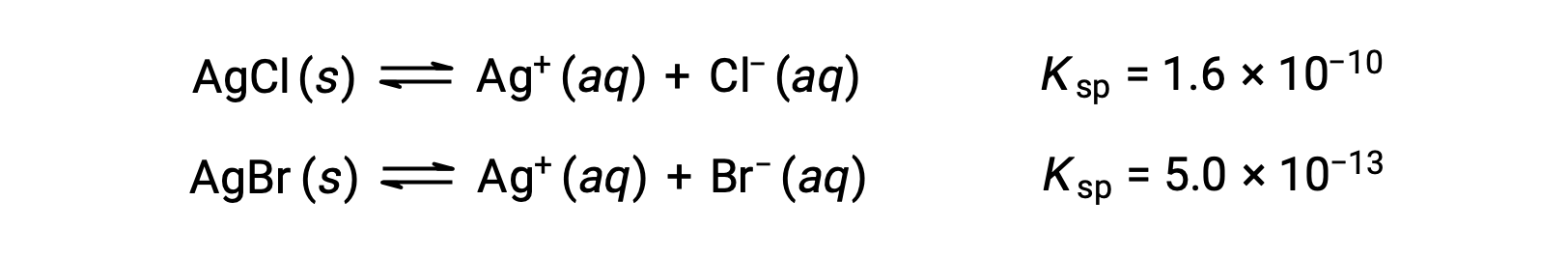
Если раствор содержит примерно равные концентрации CL– и br–, то сначала осаждаются серебряные соли с меньшим KSP (AgBr). Однако концентрации не равны, поэтому необходимо рассчитать [AG+], при котором AgCl начинает осадок, и [AG+], при котором AgBr начинает осадок. Сначала осаждается соль, образующая в нижней части [AG+].
AgBr происходит, когда Q = KSP для AgBr
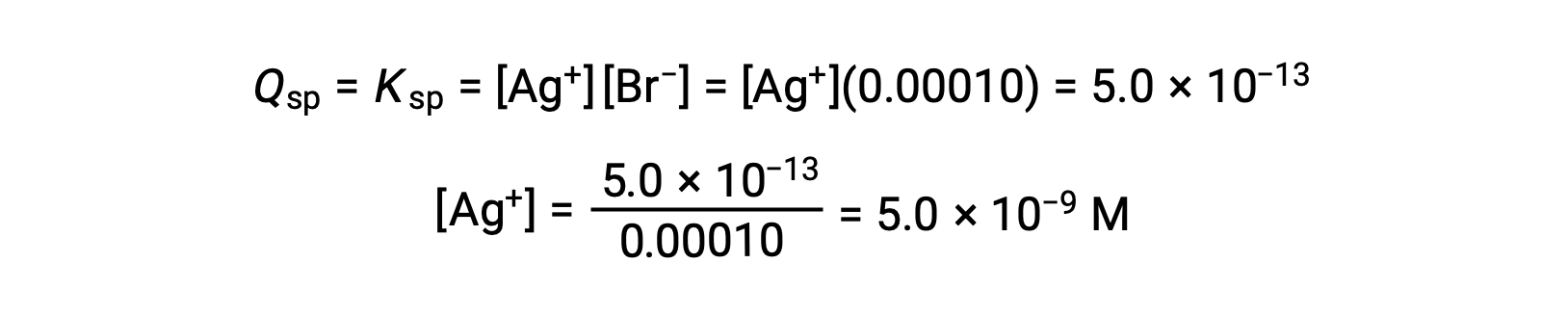
AgBr начинает осадок, когда [AG+] составляет 5.0 × 10-9 M.
Для AgCl:
AgCl выпадает, когда Q равняется KSP для AgCl (1.6 × 10-10). Когда [CL–] = 0.10 м:
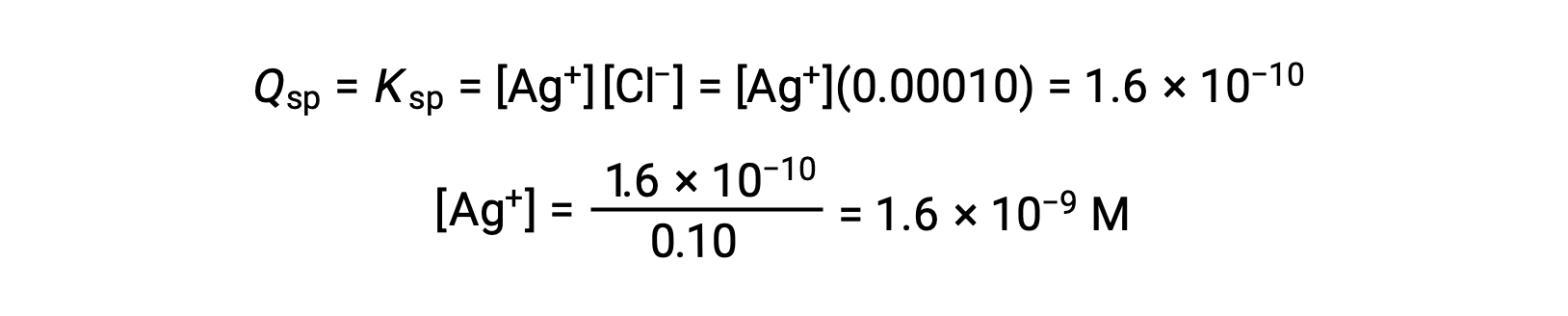
AgCl начинает осадок, когда [AG+] составляет 1.6 × 10-9 M.
AgCl начинает осадок на более низком уровне [AG+], чем AgBr, поэтому AgCl начинает сначала осадок. Обратите внимание, что концентрация иона хлорида первоначальной смеси была значительно выше, чем концентрация иона бромида, и поэтому хлорид серебра осаждался первыми, несмотря на то, что КСП больше, чем бромид серебра.
Этот текст адаптирован из Openstax, Химия 2е изд., Глава 15.1: Осадки и растворение.
