14.9:
Principio de le Chatelier: Cambios de Temperatura
25,311 Views
•
•
De acuerdo con la ley de acción de masas, un equilibrio estresado por un cambio en la concentración, cambiará para restablecer el equilibrio sin que se produzca ningún cambio en el valor de la constante de equilibrio, K. Cuando un equilibrio cambia en respuesta a un cambio de temperatura, sin embargo, se restablece con una composición relativa diferente que muestra un valor diferente para la constante de equilibrio.
Para entender este fenómeno, considere la reacción elemental:
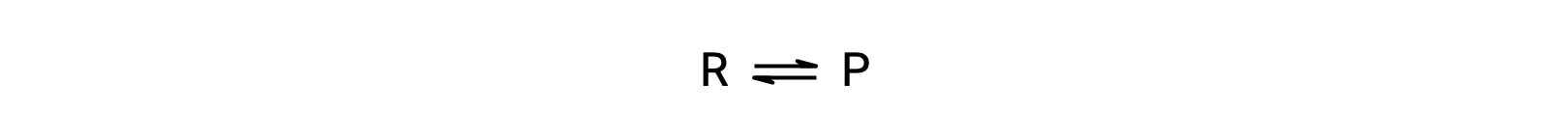
Dado que se trata de una reacción elemental, las leyes de velocidad para el avance y el retroceso pueden derivarse directamente de la estequiometría de la ecuación balanceada:
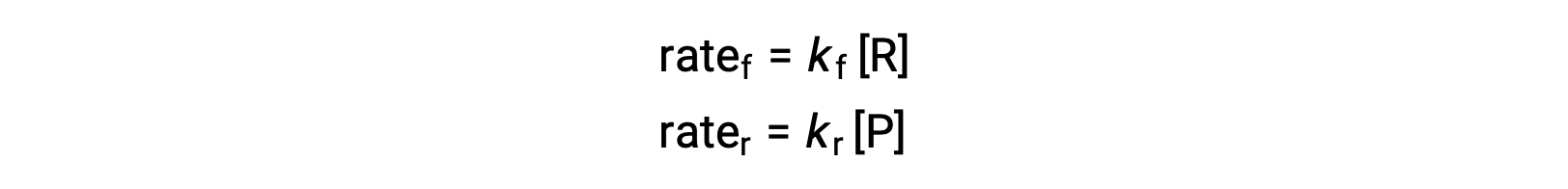
Cuando el sistema está en equilibrio,
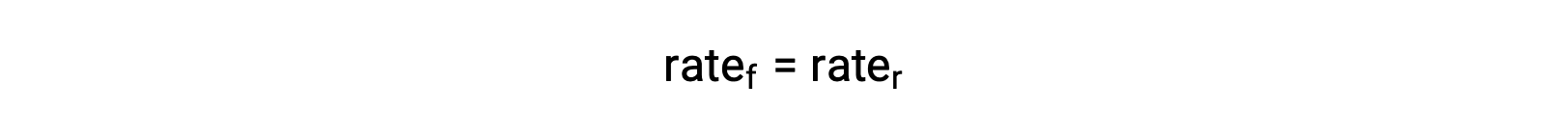
Substituyendo las leyes de velocidad en esta igualdad y reorganizando se obtiene
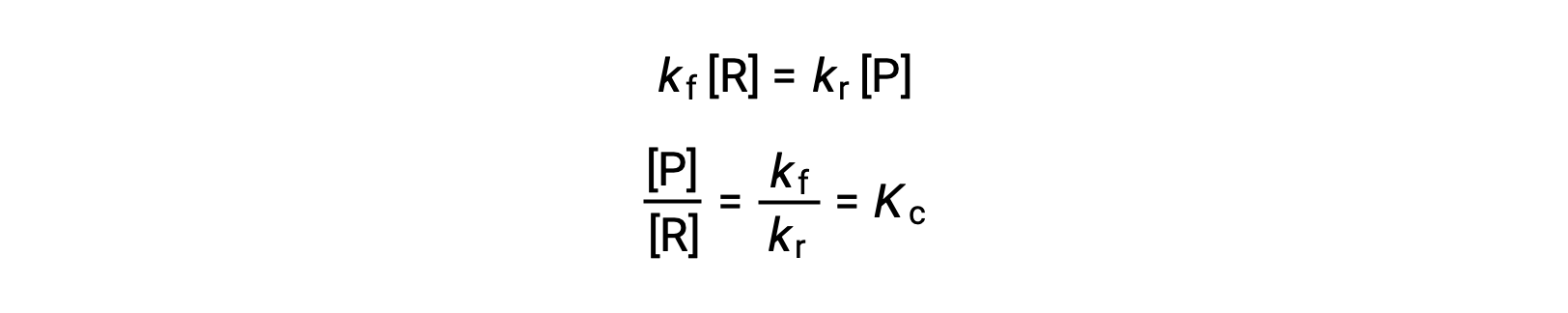
La constante de equilibrio se puede expresar como una función matemática de las constantes de velocidad para las reacciones de avance y retroceso. Dado que las constantes de velocidad varían con la temperatura, tal como se describe en la ecuación de Arrhenius, es lógico que la constante de equilibrio también varíe con la temperatura (suponiendo que las constantes de velocidad se vean afectadas en diferentes grados por el cambio de temperatura). Para reacciones más complejas que implican mecanismos de reacción de varios pasos, existe una relación matemática similar pero más compleja entre la constante de equilibrio y las constantes de velocidad de los pasos en el mecanismo. Independientemente de lo compleja que sea la reacción, persiste la dependencia entre la constante de equilibrio y la temperatura.
Predecir el cambio que un equilibrio experimentará en respuesta a un cambio en la temperatura se logra más convenientemente considerando el cambio de entalpía de la reacción. Por ejemplo, la formación de amoníaco por el proceso de Haber es un proceso exotérmico (que produce calor):
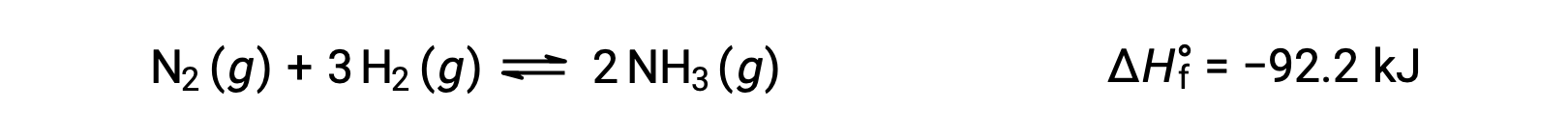
Para aplicar el principio de Le Châtelier, el calor,q, puede considerarse un producto:
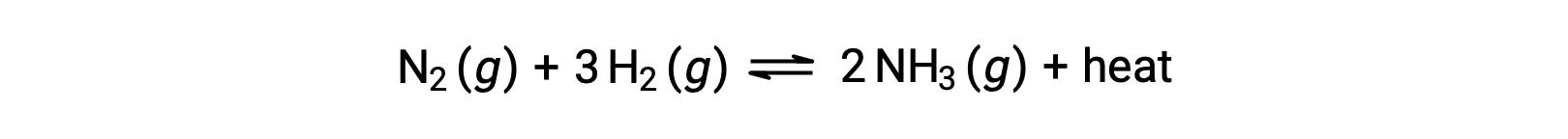
Elevar la temperatura del sistema es similar a aumentar la cantidad de un producto, y así el equilibrio se desplazará hacia la izquierda. Al bajar la temperatura del sistema, el equilibrio se desplazará hacia la derecha. Para los procesos endotérmicos, el calor se considera como un reactivo de la reacción y, por lo tanto, se observa la dependencia opuesta de la temperatura.
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.3 Cambios de los Equilibrios: Principio de Le Châtelier.
