Acquisition et analyse d'un signal ECG (électrocardiographie)
English
分享
概述
Source : Peiman Shahbeigi-Roodposhti et Sina Shahbazmohamadi, Département de génie biomédical, Université du Connecticut, Storrs, Connecticut
Un électrocardiographe est un graphique enregistré par les changements potentiels électriques se produisant entre les électrodes placées sur le torse d’un patient pour démontrer l’activité cardiaque. Un signal ECG suit le rythme cardiaque et de nombreuses maladies cardiaques, telles que le mauvais flux sanguin vers le cœur et les anomalies structurelles. Le potentiel d’action créé par les contractions de la paroi cardiaque propage les courants électriques du cœur dans tout le corps. Les courants électriques de propagation créent différents potentiels à des points dans le corps, qui peuvent être sentis par des électrodes placées sur la peau. Les électrodes sont des transducteurs biologiques faits de métaux et de sels. En pratique, 10 électrodes sont fixées à différents points sur le corps. Il existe une procédure standard pour l’acquisition et l’analyse des signaux ECG. Une vague ECG typique d’un individu en bonne santé est la suivante:
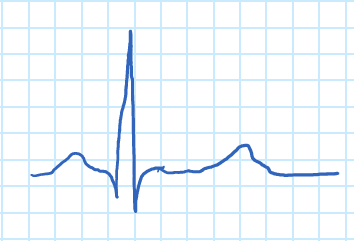
Figure 1. Vague ECG.
L’onde « P » correspond à une contraction auriculaire et au complexe « QRS » à la contraction des ventricules. Le complexe “QRS” est beaucoup plus grand que l’onde “P” en raison de la dfference relative dans la masse musculaire des oreillettes et des ventricules, qui masque la relaxation des oreillettes. La relaxation des ventricules peut être vu sous la forme de la vague “T”.
Il y a trois pistes principales chargées de mesurer la différence de potentiel électrique entre les bras et les jambes, comme le montre la figure 2. Dans cette démonstration, l’une des pistes de membre, le plomb I, sera examinée, et la différence de potentiel électrique entre deux bras sera enregistrée. Comme dans toutes les mesures de plomb ECG, l’électrode reliée à la jambe droite est considérée comme le nœud du sol. Un signal ECG sera acquis à l’aide d’un amplificateur biopotentiel, puis affiché à l’aide d’un logiciel d’instrumentation, où un contrôle de gain sera créé pour ajuster son amplitude. Enfin, l’ECG enregistré sera analysé.
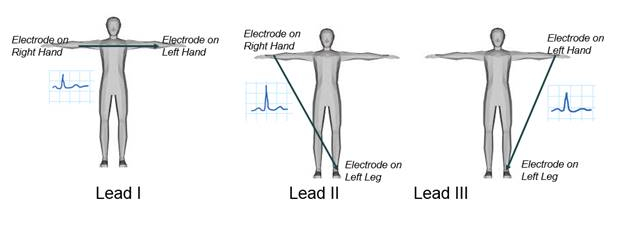
Figure 2. Le membre d’ECG mène.
Principles
L’électrocardiographe doit être capable de détecter non seulement des signaux extrêmement faibles allant de 0,5 mV à 5,0 mV, mais aussi un composant DC allant jusqu’à 300 mV (résultant du contact électrode-peau) et un composant en mode commun allant jusqu’à 1,5 V, qui résulte du potentiel entre les électrodes et le sol. La bande passante utile d’un signal ECG dépend de l’application et peut varier de 0,5-100 Hz, atteignant parfois jusqu’à 1 kHz. Il est généralement d’environ 1 mV de pointe à pic en présence de bruit externe à haute fréquence beaucoup plus grand, 50 ou 60 Hz interférence, et d’électrode DC potentiel de compensation. D’autres sources de bruit incluent le mouvement qui affecte l’interface peau-électrode, les contractions musculaires ou les pointes électromyographiques, la respiration (qui peut être rythmique ou sporadique), les interférences électromagnétiques (EMI) et le bruit d’autres appareils électroniques ce couple dans l’entrée.
Tout d’abord, un amplificateur biopotentiel sera produit pour traiter l’ECG. Ensuite, des électrodes seront placées sur le patient pour mesurer la différence potentielle entre deux bras. La fonction principale d’un amplificateur biopotentiel est de prendre un signal électrique faible d’origine biologique et d’augmenter son amplitude afin qu’il puisse être traité, enregistré ou affiché.

Figure 3. Amplificateur ECG.
Pour être utiles biologiquement, tous les amplificateurs biopotentiels doivent répondre à certaines exigences de base :
- Ils doivent avoir une forte impédance d’entrée de sorte qu’ils fournissent une charge minimale du signal mesuré. Les électrodes biopotentielles peuvent être affectées par leur charge, ce qui entraîne une distorsion du signal.
- Le circuit d’entrée d’un amplificateur biopotentiel doit également assurer une protection au sujet étudié. L’amplificateur doit avoir des circuits d’isolement et de protection de sorte que le courant à travers le circuit d’électrode peut être maintenu à des niveaux sûrs.
- Le circuit de sortie conduit la charge, qui est généralement un dispositif d’indication ou d’enregistrement. Pour obtenir une fidélité et une portée maximales dans la lecture, l’amplificateur doit avoir une faible propédance de sortie et être capable de fournir la puissance requise par la charge.
- Les amplificateurs biopotentiels doivent fonctionner dans le spectre de fréquences dans lequel les biopotentiels qu’ils amplifient existent. En raison du faible niveau de ces signaux, il est important de limiter la bande passante de l’amplificateur pour obtenir des rapports signaux/bruit optimaux. Cela peut être fait à l’aide de filtres.
La figure 3 est un exemple d’amplificateur ECG, et la figure 4 est le circuit de l’amplificateur ECG qui est construit lors de cette démonstration. Il comporte trois étapes principales : le circuit de protection, l’amplificateur d’instrumentation et le filtre à col élevé.

Figure 4. Amplificateur biopotentiel.
La première étape est les circuits de protection des patients. Une diode est un dispositif semi-conducteur qui conduit le courant dans une direction. Lorsqu’une diode est orientée vers l’avant, la diode agit comme un court-circuit et conduit l’électricité. Lorsqu’une diode est inversée, elle agit comme un circuit ouvert et ne conduit pas d’électricité, jer 0.
Lorsque les diodes sont dans la configuration orientée vers l’avant, il y a une tension connue sous le nom de tension de seuil (VT – environ 0,7 V) qui doit être dépassée pour que la diode puisse conduire le courant. Une fois que le VT a été dépassé, la chute de tension à travers la diode restera constante à VT indépendamment de ce que Vest.
Lorsque la diode est inversée, la diode agira comme sur le circuit ouvert et la chute de tension à travers la diode sera égale à Ven.
La figure 5 est un exemple d’un circuit de protection simple basé sur des diodes qui seront utilisées dans cette démonstration. La résistance est utilisée pour limiter le courant qui circule à travers le patient. Si une défaillance dans l’amplificateur d’instrumentation ou les diodes court-circuite la connexion du patient avec l’un des rails électriques, le courant serait inférieur à 0,11 mA. Les diodes à faible fuite FDH333 sont utilisées pour protéger les entrées de l’amplificateur d’instrumentation. Chaque fois que la tension dans le circuit dépasse 0,8 V de magnitude, les diodes changent pour leur région active ou état ” ON “; le courant circule à travers eux et protège à la fois le patient et les composants électroniques.

Figure 5. Circuit de protection.
La deuxième étape est l’amplificateur d’instrumentation, IA, qui utilise trois amplificateurs opérationnels (op-ampli). Il y a un op-amp attaché à chaque entrée pour augmenter la résistance d’entrée. Le troisième op-amplis est un amplificateur différentiel. Cette configuration a la capacité de rejeter les interférences référées au sol et ne fait qu’amplifier la différence entre les signaux d’entrée.

Figure 6. Amplificateur d’instrumentation.
La troisième étape est le filtre à passage élevé, qui est utilisé pour amplifier une petite tension AC qui monte sur le dessus d’une grande tension DC. L’ECG est affecté par des signaux de basse fréquence qui proviennent du mouvement du patient et de la respiration. Un filtre à col élevé réduit ce bruit.
Des filtres de passage élevé peuvent être réalisés avec des circuits RC de premier ordre. La figure 7 montre un exemple de filtre de premier ordre et sa fonction de transfert. La fréquence de coupure est donnée par la formule suivante :
 ,
,



Figure 7. Filtre de passage élevé.
Procedure
Results
In this demonstration, three electrodes were connected to an individual, and the output passed through a biopotential amplifier. A sample ECG graph prior to digital filtering is shown below (Figure 8).

Figure 8. ECG signal without digital filtering.
After designing the filters and feeding the data to the developed algorithm, the peaks on the graph were detected and used to calculate heart beat rate (BPM). Figure 9 displays the raw data an ECG signal (before any filtering) in time and frequency domain. Figure 10 shows the result of filtering that signal.

Figure 9. ECG signal before filtering.

Figure 10. Filtered ECG signal.
The original ECG plot had slightly visible P, QRS, and T complexes that presented many fluctuations from the noise. The spectrum of the ECG signal also showed a clear spike at 65 Hz, which was assumed to be noise. When the signal was processed using a low-pass filter to remove extraneous high frequency portions and then a band-stop filter to remove the 65 Hz signal component, the output appeared significantly cleaner. The ECG shows each component of the signal clearly with all noise removed.
In addition, the measured heart rate was approximately 61.8609 beats per minute.
Applications and Summary
Contraction of cardiac muscle during the heart cycle produces electric currents within the thorax. Voltage drops across resistive tissue are detected by electrodes placed on the skin and recorded by an electrocardiograph. Since the voltage is weak, in the range of 0.5 mV, and small compared to the magnitude of noise, processing and filtering the signal is necessary. In this experiment, an electrocardiograph device consisting of a two part analog and digital signal processing circuit was designed to analyzing the resulting ECG signal, and calculate the heartbeat rate.
This demonstration introduced the fundamentals of electronic circuitry and filtering of ECG signals. Here, practical signal processing techniques were used to extract a weak signal from a noisy background. These techniques can be used in other similar applications where signal amplification and noise reduction is required.
Materials List
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Power supply | B&K Precision | 1760A | |
| Multimeter | |||
| Oscilloscope | |||
| Proto-board | |||
| 4 FDH333 diodes | |||
| 1 AD620 | |||
| 3 47kΩ resistor | |||
| 2 100nF capacitors | |||
| 3 ECG electrodes | |||
| Several alligator clips and Tektronix probe. |
成績單
Electrocardiographs record cardiac activity of the heart and are used to diagnose disease, detect abnormalities, and learn about overall heart function. Electrical signals are produced by contractions in the heart walls which drive electrical currents and create different potentials throughout the body. By placing electrodes on the skin, one can detect and record this electrical activity in an ECG. ECGs are non-invasive, making them a useful tool to assess how well a patients heart is performing, such as by measuring how well blood flows to the organ.
This video will illustrate the principals of ECGs and demonstrate how to acquire, process, and analyze a typical ECG signal using a biopotential amplifier. Other biomedical applications that utilize electrical signal processing to diagnose disease will also be discussed.
To understand the principles of an ECG, let’s first understand how the heart produces electrical signals. For a normal, healthy heart, at rest, an ECG displays a series of waves that reflect the different phases of a heartbeat. The ECG starts in the sinoatrial node, also known as the SA node, which is located in the right atrium and acts as a pacemaker in the heart. The electrical signals cause atrial contraction forcing blood into the ventricles. This sequence is recorded as the P wave on the ECG. This signal then passes from the atria across the ventricles, causing them to contract and pump blood to the rest of the body. This is recorded as the QRS complex.
Finally, the ventricles relax and this is recorded as the T wave. The process then begins again and is repeated for every heartbeat. Notice that the QRS wave is much larger than the P wave, this is because the ventricles are larger than the atria. Meaning they mask the relaxation of the atria or the T wave. Other processes in the body, like respiration or muscle contractions, can interfere with the ECG measurement. As can currents from the circuitry used to obtain them. Often, the electrical signals that the ECG is attempting to record are quite weak. Therefor, a biopotential amplifier is used to increase their amplitude which allows them to be further processed and recorded.
There are three main components to the biopotential amplifier, the patient protection stage, the instrumentation amplifier, and the high pass filter. As the main suggests, the patient protection circuit uses a combination of resistors and diodes to protect, both, the patient and the machine and equipment. The resistors limit the current that flows through the patient, where as the diodes keep the current flowing in the correct direction.
The next stage is the instrumentation amplifier, which amplifies the difference between the inputs from each electrode. It is composed of three operational amplifiers. Two to increase the resistance from each input, and the third to amplify the difference between the input signals.
The last stage is the high pass filter, which reduces the noise and filters out low frequency signals arising from patient movement or respiration. Now that you know how an ECG is measured, let’s see how to construct a biopotential amplifier and process the data to get a clean ECG signal.
Having reviewed the main principals of electrocardiography, let’s see how to build a biopotential amplifier and acquire an ECG signal. To begin, first gather a proto-board, an AD-620 instrumentation amplifier, and all necessary circuit components. Then, calculate the values of all of the resistors and capacitors in the circuit using the following equation.
For the high pass filter, the cut off frequency should be 0.5 hertz.
Then, plug in the capacitor value to determine the resistance. Next, build a biopotential amplifier according to the provided diagram. Here is what the final circuit should look like. Attach three wires with alligator clips to the binding posts of a DC power supply, then turn on the power source. Adjust the voltage to plus five volts and minus five volts, and connect the the wires, in series, to the circuit.
Now, use an alcohol prep pad to wipe the patients right wrist, left wrist, and right ankle. Add conductive adhesive gel to the electrodes before placing them on the patient. Then, connect the electrodes to the circuit using wires with alligator clips. Turn on the oscilloscope and acquire the ECG signal. Adjust the horizontal and vertical scales as needed. With these adjustments, you should be able to see the R peak of the wave form.
Connect the circuit to the PXI chassis, then open the instrumentation software and, either, use or write a program that will display the ECG signal and a wave form graph.
Configure the data acquisition interface with the following settings. Label the scale of the x-axis to display time and seconds, then display the ECG signal as a waveform. If the signal needs to be amplified, create a gain control and set it so that the amplitude of the ECG is two VP.
Now that we have demonstrated how to acquire an ECG signal, let’s see how to analyze the results. Here is a representative ECG signal. The P, QRS, and T waves are barely discernible because they are obscured by noise and fluctuations. This signal needs to be filtered. To transform this signal, first, select Signal Processing then Spectral on the menu. A Fast Fourier Transform algorithm calculates and plots the spectrum of the signal displaying the frequency as discreet values on the horizontal axis. Most of the energy in the signal is at low frequencies.
But, there is a high intensity peak in the medium frequency range, which is assumed to be noise. Frequency is plotted as k on the horizontal axis and goes from zero to N minus one over two, where N is the length of the sequence. For this experiment, N equals 2,000. Calculate the analog frequency for each k value using the following equation, where f s is the sampling frequency and determine the frequency of the high intensity peak based on the FFT graph.
Then, create a low pass filter with a cutoff frequency of 100 hertz. Use, either, the Butterworth or Chebyshev function to filter the signal, which should attenuate at least 60 decibels per decade in the stop band. Connect the output signal of the data sub VI to the input of the low pass filter. This filter removes the extraneous high frequency waves of the ECG. Now, create a Bandstop filter and set the cutoff frequencies at around 55 and 70 hertz.
To remove the noisy signal, around 60 hertz. Then, connect the output of the low pass filter to the input of the Bandstop filter. Try border frequencies that are close to 60 hertz. This will reduce interference without effecting other frequencies. The ECG signal should now be clear with distinct P, QRS, and T complexes.
Now, let’s determine the heart rate using the filtered ECG signal. First, use the peak detector sub VI to find the peaks of the signal. Choose the most appropriate value based on the signals amplitude of the R wave for the threshold. Then, use the Index Array sub VI to determine the location of the peaks.
Subtract the lower peak position from the higher position, then multiply this value by the sampling period, T, which is equal to one over f s. This value is the length of time between two R waves. Adjust the units to determine the beats per minute.
In this demonstration, the measured heart rate was approximately 60 beats per minute.
ECG and signal processing have important applications in, both, medicine and research. In addition to being non-invasive, ECGs are relatively inexpensive. Making it a useful and accessible tool in hospitals. ECGs can even be adapted to more complex and longterm monitoring of patients who are being treated for Acute Coronary Syndrome.
For this, 12 ECG leads are used, which can identify transient myocardial ischemia in asymptomatic patients. Signal sampling and processing is also used in electroencephalography to measure electrical signals from the brain. EEGs are commonly used in conjunction with functional MRI as a multimodal imaging technique.
The method noninvasively generates cortical maps of brain activity for many neuroimaging applications, such as after visual or motor activation.
You’ve just watched Jove’s introduction to acquiring and analyzing ECG signals. You should now understand how an ECG signal is produced and how to create a biopotential amplifier to detect weak electrical signals. You have also seen some biomedical applications of signal processing for medical diagnosis.
Thanks for watching.
