18.4:
标准电极电势
18.4:
标准电极电势
通过比较银和铅的活性,可以观察到两种离子体 AFP+ (AQ) 和 Pb2+ (AQ) 在对铜的氧化还原反应方面有差异:银离子会自动减少,而铅离子不会自动减少。 这种相对氧化还原活动可以通过称为电池电势的属性在电化学细胞中轻松量化。 该属性在电化学中通常称为电池电压,它是电荷转移随附的能量的测量值。 电位是使用 SI 单位电压测量的,该单位电压定义为每充电一个库伦一焦耳能量。 因此,

标准电极电势
当出于电化学目的进行测量时,电池电势是特定类型电荷转移过程 (即反应物之间的电子转移) 的驱动力度量单位。 无法测量单个电极或单个半电池的电位,因为电子传输分别需要施药者和植入者,或还原剂和氧化剂。 相反,半电池电位只能相对于另一个半电池进行测量。 因此,只能测量两个半电池 (Ecell) 之间的电位差,这两个 Ecell 被定义为

其中,阴极和阳极分别代表两种不同的半电池分别用作阴极和阳极的电位。 标准电池电势 (E°) 单元是在两个半电池的标准状态条件下测得的电池电势 (即, 1 M 浓度, 1 bar 压力, 298 K)

为了轻松计算半反应电位,科学界指定了一个特定的半电池作为所有电池电势测量的通用参考,电位为 0 V。 该半电池被称为标准氢电极 (SHE) ,它基于以下半反应:

通常, SHE 由一个惰性铂电极组成,该电极浸入 1 M 水性 H+ 中,并在 1 bar 压力下产生气泡 H2 气体, 因此,半电池 X 的电极电位 (EX) 被定义为作为阴极的细胞 X 的电位测量值,而 SHE 则作为阳极。
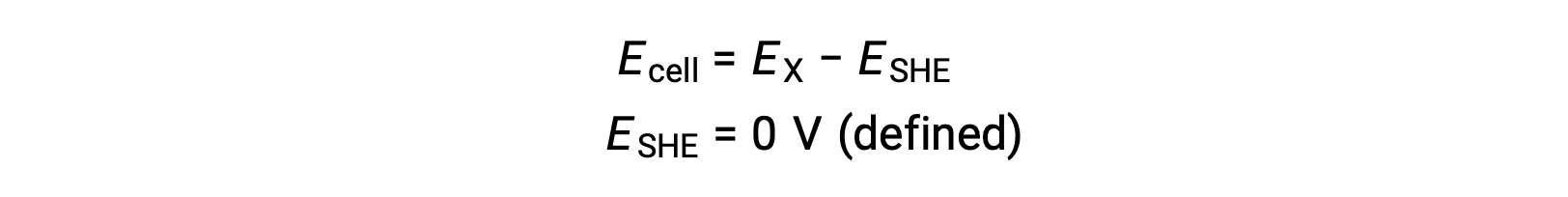
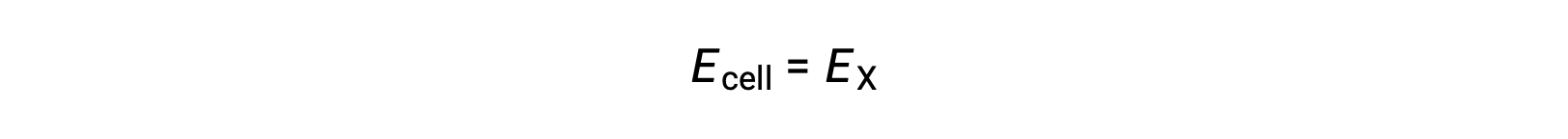
在标准状态条件下,半电池 X 的电位等于标准电极电势 E°X 由于电池电势的定义要求半电池作为阴极运行,因此这些电位也称为标准降低电位。
预测自发性和氧化还原反应的方向
细胞和电极电位决定氧化还原反应的自发性。 据观察,自发反应显示电池电势呈阳性,而非自发过程显示电池电势呈阴性。 如果电极电位的总和为正,则反应被认为是自发的。 正向发生半电池电极电位正极反应,而数值小于氢电极的反应通常以相反顺序发生。
一种更强的氧化剂显示出更大的标准电极电势, E°。 随着电极电位测量减量, E° 的增加相当于物种减少和氧化能力提高后驱动力的增加。 因此,当 E°阴极 > E°阳极时, E°单元为正极。
考虑到这一点,它解释了为什么铜被银氧化而不是铅氧化:
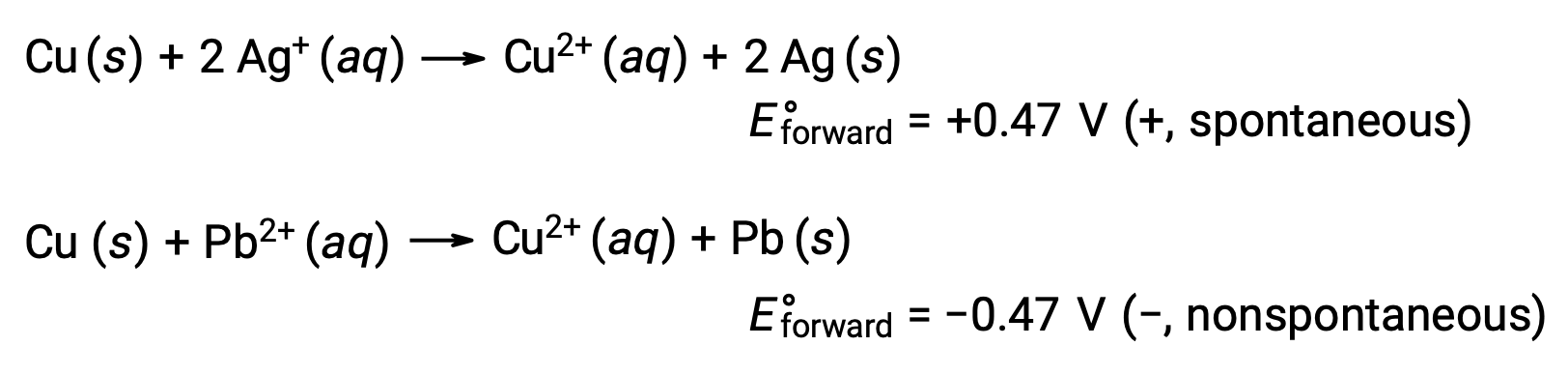
预测矿物酸中的金属溶解
半电池电位的一个重要应用是了解特定金属在矿物酸中是否会发生溶解。 大多数酸 (如盐酸溶解金属) 通过将质子还原为氢气并将金属氧化至各自的离子。 如果锌与盐酸反应,则反应是自发的,因为锌的标准电极电势低于氢的。 但是,铜由于其电极电位较高,因此不会与盐酸发生反应。
