18.2:
Force électromotrice
21,664 Views
•
•
L’électricité est générée par des électrons ou par des ions qui traversent une solution ou un milieu conducteur. Ce flux d’électrons, ou plus précisément la charge électrique, est défini comme un courant électrique. Lorsque les électrons se déplacent à travers un fil, ils génèrent un courant électrique. On peut rappeler que dans une réaction redox, les électrons sont perdus et gagnés. Dans la réaction redox spontanée du zinc avec le cuivre, lorsque le zinc est immergé dans une solution d’ions cuivre, il se produit un transfert d’électrons d’une substance à une autre.
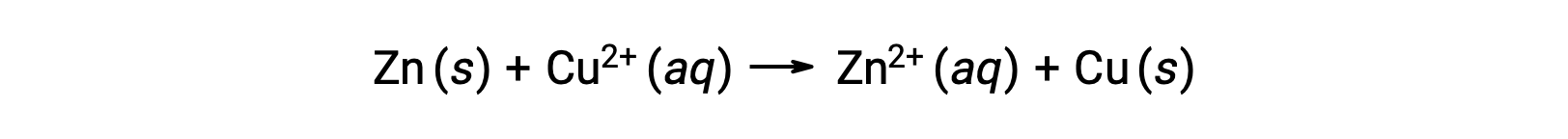
Le zinc, qui a le plus tendance à perdre des électrons, est oxydé en ions zinc, alors que les ions cuivre sont réduits en cuivre solide. Toutefois, cette réaction ne génère pas d’électricité.
Courant électrique et flux d’électrons
Le transfert d’électrons se produit directement d’un agent réducteur vers un agent oxydant dans une solution. Même si les constituants des demi-réactions sont physiquement isolés dans des réceptacles séparés et connectés via un conducteur externe tel qu’un fil, la tendance qu’ont les réactifs à perdre et à gagner des électrons persiste. Cependant, les électrons sont maintenant forcés de circuler à travers le fil reliant les deux demi-réactions. Ce flux d’électrons à travers le fil constitue un courant électrique et peut alimenter des appareils électroniques, comme une ampoule. Le courant électrique est mesuré en ampères. Un ampère est égal au débit d’une charge électrique d’un coulomb par seconde et il est égal à 6,24 × 10−18 électrons par seconde.
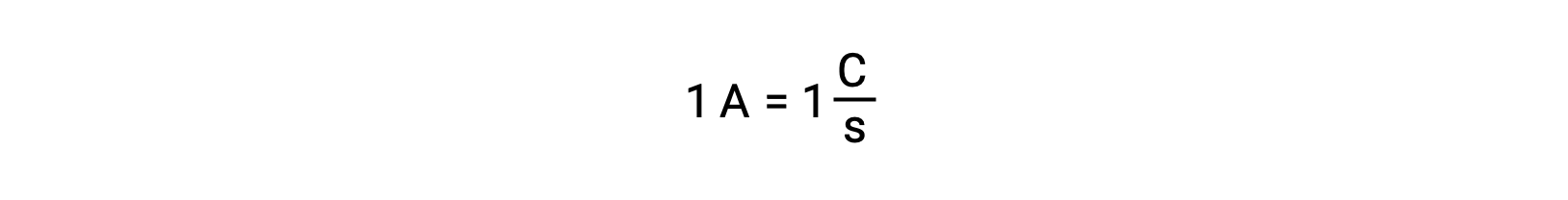
Comme un électron a une charge de 1,602 × 10−19 C, 1 ampère correspond au débit de 6,242 × 1018 électrons par seconde.
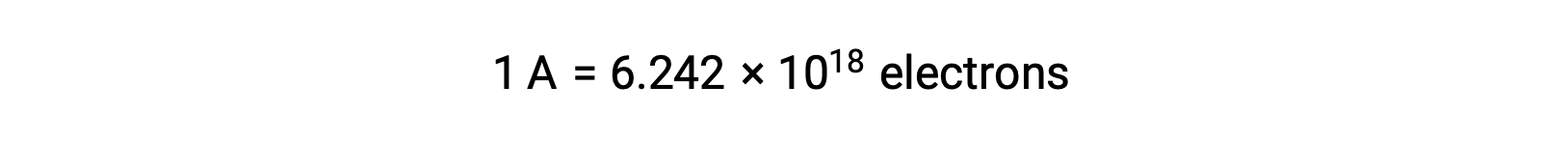
Force motrice pour le courant électrique, différence de potentiel et Fém
Le flux de courant électrique est similaire à l’eau qui coule dans une cascade. L’eau est entraînée par la différence d’énergie potentielle gravitationnelle, tandis que le flux d’électrons est entraîné par la différence d’énergie potentielle électrique entre les réactifs. Cette différence d’énergie potentielle électrique est décrite par les termes différence de potentiel, force électromotrice (Fém) ou potentiel de la cellule. La Fém est une mesure de la force motrice entre deux réactifs et de la tendance au transfert d’électrons.
Certaines réactions redox sont spontanées, alors que d’autres ne le sont pas. Par exemple, un fil de cuivre subit une oxydation spontanée par les ions argent(I), mais ne produit aucune réaction lorsqu’il est immergé dans une solution d’ions plomb(II). Ceci est dû à la différence entre l’activité redox des deux espèces, Ag+ (aq) et Pb2+ (aq) pour le cuivre : l’ion argent oxyde spontanément le cuivre, mais pas l’ion plomb. En électrochimie, cette différence de réactivité redox peut être quantifiée à l’aide du terme ‘ potentiel de cellule ’, également connu sous le nom de ‘ tension ’.
Le potentiel de cellule de deux réactifs isolés est mesuré à l’aide d’un voltmètre, qui est lu en tension de cellule. Un volt correspond à un joule d’énergie potentielle par coulomb de charge électrique.
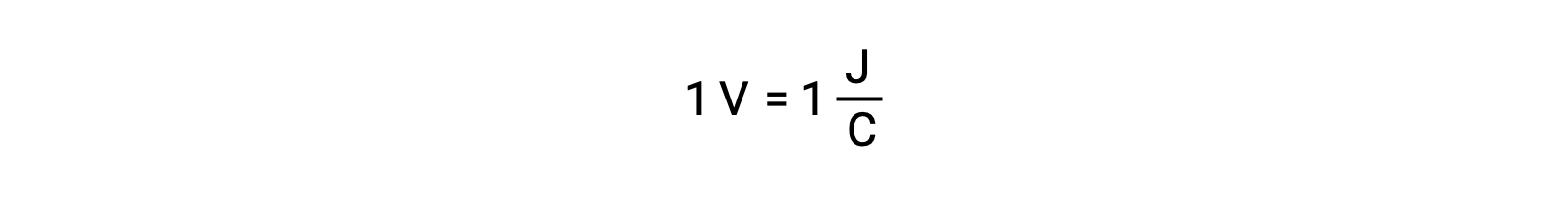
Un potentiel de cellule élevé indique une force motrice importante et une plus grande facilité de transfert d’électrons. Enfin, la force électromotrice, ou le potentiel de la cellule, dépend de la nature des réactifs, de la température de la réaction et de la concentration des ions présents dans la réaction.
Ce texte est adapté de OpenStax, Chimie 2e, Section 17.3 : Potentiels d’électrode et de cellule.
